
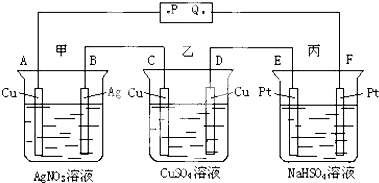
| A、P是电源的正极 |
| B、F极上发生的反应为:4OH--4e-=2H2O+O2↑ |
| C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应 |
| D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大压强 |
| B、降低温度 |
| C、加入催化剂 |
| D、减小反应物浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B、2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| C、用锡焊接的铁质器件,焊接处易生锈 |
| D、对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4═Na++HSO4- |
| B、Na2CO3═2Na++CO32- |
| C、MgCl2═Mg2++2Cl2- |
| D、Ba(OH)2═Ba2++(OH)2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com