
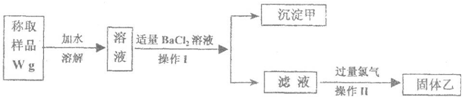
| W1g |
| 233g/mol |
| W1 |
| 233 |
| W1 |
| 233 |
| W1 |
| 233 |
| 174W1 |
| 233W |
| 174W1 |
| 233W |
 ,
, .
.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4?FeSO4?6H2O | 17.2 | 26.4 | 33.0 | 46.0 | - | - |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cu2+、SO42-、NO3- |
| B、Na+、Ba2+、Br-、SO42- |
| C、NH4+、Fe3+、Cl-、SCN- |
| D、K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发展循环经济,构建资源节约型社会 |
| B、大量砍伐森林,以满足人们对木材的需求 |
| C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃 |
| D、采用“绿色化学”工艺,建立环境友好型化工体系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com