
NA代表阿伏加德罗常数,下列叙述正确的是
A.0.1 mol丙烯酸中含有双键的数目为0.1NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA
C.一定条件下定容容器中充入3molH2(g)和1 mol N2(g)发生反应:H2(g)+ N2(g) 2NH3 (g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA
2NH3 (g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA
D.在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:实验题
(14分)硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:
I、酸性条件下,锡在水溶液中有Sn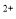 、Sn
、Sn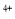 两种主要存在形式,Sn
两种主要存在形式,Sn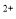 易被氧化。
易被氧化。
Ⅱ、SnCl2易水解生成碱式氯化亚锡[Sn(OH)C1]。
回答下列问题:
(1)操作1的步骤为 、 、过滤、洗涤、干燥。对沉淀进行洗涤的方法是 。
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式及化学反应原理解释原因: 。
(3)加入Sn粉的作用有两个:①调节溶液pH;② 。
(4)SnSO4还可在酸性条件下用作双氧水的去除剂,发生反应的离子方程式是: 。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取质量为m的锡粉溶于稀硫酸中,向生成的SnSO4中加入过量的Fe2(SO4)3溶液,用物质的量浓度为c的K2Cr2O7标准溶液滴定生成的Fe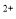 (已知酸性环境下Cr2O
(已知酸性环境下Cr2O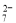 可被还原为Cr
可被还原为Cr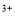 ),共用去K2Cr2O7溶液的体积为V。则锡粉中锡的质量分数是 。(Sn的摩尔质量为M,用含m、c、V、M的代数式表示)
),共用去K2Cr2O7溶液的体积为V。则锡粉中锡的质量分数是 。(Sn的摩尔质量为M,用含m、c、V、M的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列对化学科学的认知错误的是
A.化学是一门以实验为基础的自然科学
B.化学家可以制造出自然界中不存在的物质
C.物质发生化学反应都伴随着能量变化
D.化学研究会造成严重的环境污染,人类终将毁灭在化学物质中
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:填空题
(11分)(1)请用下列物质的序号填空:①NaF ②C2H4 ③Na2O2 ④ Ba(OH)2 ⑤ CO2;只含有极性键的是 ,既有离子键又有非极性键的是 。
(2)C、N、O三种元素的第一电离能由大到小的顺序是 。某氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(3)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物。回答下列问题:
①写出基态Cu2+的核外电子排布式: ;在周期表中的位置是 。
②如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为 。
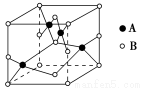
③CuO高温易转化为Cu2O,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
已知A、B为单质,C为化合物, ,能实现上述转化关系的是
,能实现上述转化关系的是
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
已知33As、35Br位于同一周期。下列关系正确的是
A.原子半径:As>Cl>P B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl- D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源:2015届吉林省长春外国语学校高三上学期期中理综化学试卷(解析版) 题型:填空题
(14分)已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
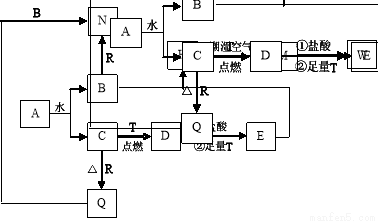
(1)写出下列物质的化学式:D:____________,R:_______________;
写出下列物质的电子式A: ;
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式:__________________;
B与R反应的化学方程式:___________________________ ;
D与盐酸反应的离子方程式:________________________。
(3)向沸水中加入W饱和溶液,可制得一种红褐色胶体,该反应的离子方程式为:_________。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三第三次月考化学试卷(解析版) 题型:选择题
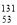 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中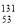 I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关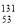 I的叙述中错误的是
I的叙述中错误的是
A.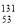 I的化学性质与
I的化学性质与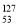 I相同
I相同
B.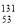 I的原子序数为53
I的原子序数为53
C.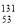 I的原子核外电子数为78
I的原子核外电子数为78
D.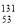 I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源:2015届吉林省吉林市高三第一次摸底考试化学试卷(解析版) 题型:填空题
(13分)(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
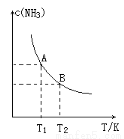
①当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。若已知:①N2(g)+3H2(g)=2NH3(g) △H=a kJ/mol ②2H2(g)+O2(g)=2H2O(l) △H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如右图所示,则阴极的电极反应式是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com