
| A. | W、Y的原子序数a>c | B. | 离子的还原性Y2-<Z- | ||
| C. | 原子最外层电子数Y<W | D. | 离子半径X+>Z- |
分析 四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,且W、X为金属,Y、Z为非金属,同周期自左而右,非金属性越强,阴离子还原性越强,电子层结构相同,核电荷数越大离子半径越小.
解答 解:四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,原子序数a>b>d>c.
且W、X为金属,Y、Z为非金属.
A.由于a-3=c+2,故W、Y的原子序数a>c,故A正确;
B.Y、Z同周期,原子序数c<d,故非金属性Y<Z,非金属性越强,阴离子还原性越强,故离子的还原性Y2->Z-,故B错误;
C.W形成aW3+,核外电子数为3,Y形成cY2-离子,核外电子数为6,故C错误;
D.X+、Z-离子电子层结构相同,核电荷数X>Z,核电荷数越大离子半径越小,故X+<Z-,故D错误,
故选A.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.


科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 | |
| B. | 元素R最高正价为+7价,表明R元素一定是ⅦA族元素 | |
| C. | 从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 | |
| D. | 若M+和R2-具有相同的电子层结构,则原子半径:M<R |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
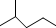 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.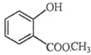 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
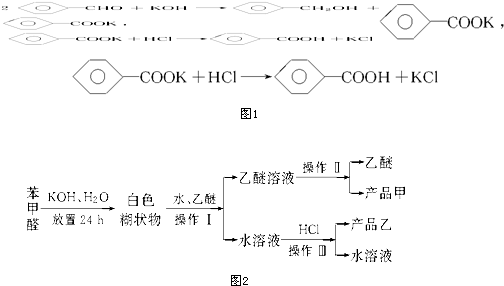
| A. | 操作Ⅰ是萃取分液 | |
| B. | 乙醚溶液中所溶解的主要成分是苯甲醇 | |
| C. | 操作Ⅱ蒸馏所得产品甲是苯甲醇 | |
| D. | 操作Ⅲ过滤得到产品乙是苯甲酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
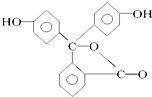
| A. | 酚酞属于芳香烃 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在碱性条件下能够发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 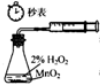 装置测定化学反应速率 | B. | 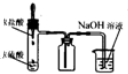 装置制取并吸收HCl | ||
| C. |  装置制备纯净NH3 | D. | 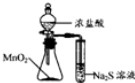 装置比较MnO2、Cl2、S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com