
| A. | 铜与浓硫酸反应生成的白色固体是CuSO4 | |
| B. | ①中灰白色固体不可能含有CuO | |
| C. | ②中的黑色固体可能含有CuS或Cu2S | |
| D. | ④中所得的白色沉淀是BaSO3 |
分析 Cu与浓H2SO4的主反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,由于浓H2SO4过量且浓硫酸具有吸水性,故所得白色固体为CuSO4;由于浓硫酸过量,黑色固体不可能为CuO;至于黑色固体成分,从题意知,它溶于浓硝酸,溶液呈蓝色说明含Cu2+,加入BaCl2溶液产生了不溶于硝酸的沉淀BaSO4,原黑色沉淀中含S元素,含Cu、S两元素,可能为CuS也可能为Cu2S,据此分析.
解答 解:A.因倒入盛有少量水的烧杯中,发现所得溶液为蓝色,说明白色固体是CuSO4,这个白色的CuSO4是由于浓硫酸具有吸水性使生成的CuSO4过饱和而析出,故A正确;
B.将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,浓硫酸稀释成稀硫酸,使CuO溶解,故黑色物质中不可能有CuO,故B正确;
C.加硝酸后黑色物质溶解溶液呈蓝色,且加BaCl2溶液后有白色沉淀生成,所以黑色物质一定含有元素Cu和S,则黑色固体可能含有CuS或Cu2S,故C正确;
D.因倒入烧杯时含有少量硫酸,所以加BaCl2溶液后所得白色沉淀是BaSO4,酸性溶液中不可能生成BaSO3,故D错误;
故选D.
点评 本题主要考查浓硫酸与铜反应物质的组成探究,题目难度中等,注意从浓硫酸的性质角度思考,根据反应实验现象进行分析,试题侧重基础知识的考查,有利于提高学生灵活应用基础知识的能力.


科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列说法正确的是
A.一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定
B.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
C.根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等
D.强电解质溶液的导电能力一定强于弱电解质溶液的导电能力
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
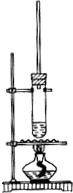 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )| A. | 为了控制温度可以用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 加入过量乙酸可以提高1-丁醇的转化率 | |
| D. | 提纯乙酸丁酯可用饱和碳酸钠溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
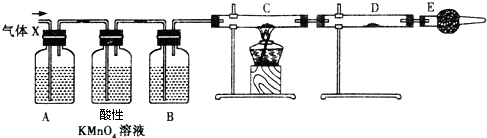
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
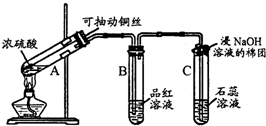
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
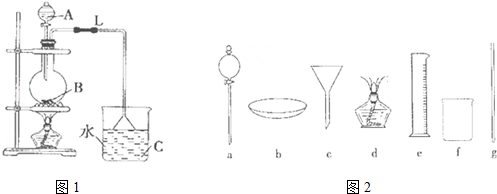
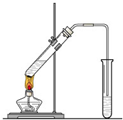 在实验室我们也可以用右图所示的装置制取乙酸乙酯.
在实验室我们也可以用右图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都减小 | B. | 正、逆反应速率都增大 | ||
| C. | 逆反应速率增大,正反应速率减小 | D. | 逆反应速率减小,正反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com