
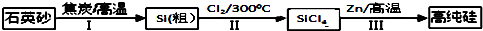
分析 (1)过程I中发生反应:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,根据碳元素化合价变化计算转移电子;
(2)电解氯化钠溶液生成氢氧化钠、氯气和氢气;
(3)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水;
(4)①SiCl4遇水剧烈水解生成SiO2和一种酸,根据原子守恒可知该酸为HCl;
②使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(5)A.Zn、Si在高温条件下都能与氧气反应;
B.反应属于可逆反应,投入的Zn不能完全反应;
C.平衡常数只受温度影响;
D.焓变△H与热化学方程式中SiCl4的物质的量有关;
(6)令水的质量为100g,则Ag2SO4的质量为0.624g,溶液密度约是水的密度,可以计算溶液的体积,进而计算Ag2SO4的物质的量浓度,再根据Ksp(Ag2SO4)=c2(Ag+)c(SO42-)求算.
解答 解:(1)过程I中发生反应:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,反应中碳元素化合价由0价升高为+2价,1mol焦炭在过程Ⅰ中失去2mol电子,故答案为:2;
(2)电解氯化钠溶液生成氢氧化钠、氯气和氢气,电解离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-
,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH-6e-+8OH-=CO32-+7H2O,故答案为:CH3OH-6e-+8OH-=CO32-+7H2O;
(4)①SiCl4遇水剧烈水解生成SiO2和一种酸,根据原子守恒可知该酸为HCl,反应方程式为:SiCl4+2H2O=SiO2+4HCl,故答案为:SiCl4+2H2O=SiO2+4HCl;
②将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中,可使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量,
故答案为:使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(5)A.Zn、Si在高温条件下都能与氧气反应,所以还原过程需在无氧的气氛中进行,故A正确
B.反应属于可逆反应,投入的Zn不能完全反应,投入1molZn生成还原产物Si的质量小于14g,故B错误;
C.平衡常数只受温度影响,增加SiCl4(g)的量,该反应平衡常数不变,故C正确;
D.焓变△H与热化学方程式中SiCl4的物质的量有关,与SiCl4的用量无关,故D错误,
故选:AC;
(6)令水的质量为100g,则Ag2SO4的质量为0.624g,则n(Ag2SO4)=$\frac{0.624g}{312g/mol}$=2×10-3mol,溶液的质量约100.624g,溶液密度约是水的密度,故溶液体积约为100.624ml≈0.1L,则Ag2SO4的物质的量浓度为2×10-2mol/L,c(SO42-)=2×10-2mol/L,c(Ag+)=4×10-2mol/L,则Ksp(Ag2SO4)=c2(Ag+)•c(SO42-)=2×10-2×(4×10-2)2=3.2×10-5,
故答案为:3.2×10-5.
点评 本题以硅的制备为载体,考查硅及其化合物的性质、氧化还原反应计算、原电池、电解原理、化学平衡相关知识、热化学方程式、溶度积计算、对操作的分析评价等,基本属于拼合型题目,需要学生具备扎实的基础,难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | 醋酸电离的程度 | ||
| C. | 中和时所需 NaOH的量 | D. | 醋酸的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol/L | B. | 0.3molL/(L•s) | C. | 0.6 molL/(L•s) | D. | 0.1 molL/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
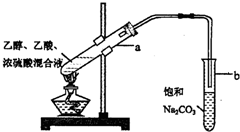
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
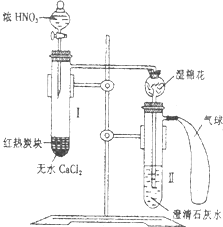 某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.
某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 | |
| B. | 用新的无害的汽油添加剂代替四乙基铅抗震剂以减少污染 | |
| C. | 火力发电用煤先进行脱硫处理,积极开发风能、生物质能发电 | |
| D. | 绿色化学要求利用化学原理从源头消除污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,实现零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖浓度太浓 | B. | 加热时间不够 | C. | NaOH的量太少 | D. | CuSO4的量太少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构 | |
| B. | 构成乙烯分子的所有原子都在同一平面内,其分子中只含有极性键 | |
| C. | 邻二甲苯没有同分异构体表明苯的凯库勒结构式存在局限,不准确 | |
| D. | 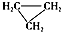 和CH3-CH═CH2互为同分异构体 和CH3-CH═CH2互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com