
一定温度下,水溶液中H+和OH-的浓度变化如图所示,下列说法不正确的是( )

A.该温度下,加入NaHSO4可能引起由b向a的变化
B.该温度下,pH=2的盐酸与pH=12的氢氧化钠溶液等体积混合,所得溶液显中性
C.该温度下,加入Na2CO3溶液能引起b向c的变化
D.降低温度可能引起b向d的变化
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:选择题
常温下,下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol/LCH3COONa溶液与0.1 mol/LCaC12溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl- )
B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3·H2O)
C.0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-)
D.0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合:c(Cl-)+c(H+)=c(NH3·H2O)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三下学期猜题理综化学试卷(解析版) 题型:填空题
亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g) 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s) NaNO3(s)+ClNO(g)K1
NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaC1(s) 2NaNO3(s)+2NO(g)+Cl2(g)K2
2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+C12(g) 2C1NO(g)K3
2C1NO(g)K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g) 2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
(3)300℃时.2NO(g)+C12(g) 2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
测得速率和浓度的关系如下表:
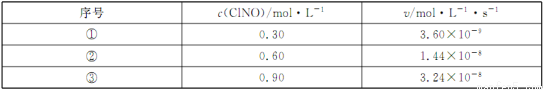
n=____________;k=____________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
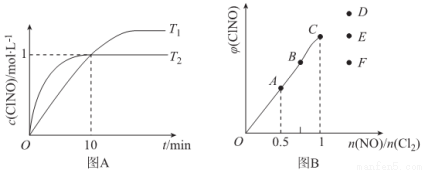
①该反应的△H____________0(填“>”“<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min),
③T2时该反应的平衡常数K=____________
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三高考打靶测试理综化学试卷(解析版) 题型:选择题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
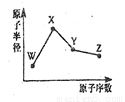
A.对应简单离子半径:W>X
B.对应气态氢化物的稳定性:Y<Z
C.化合物XZW既含离子键,又含极性共价键
D.Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:填空题
【化学选修3:物质结构与性质】Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是__________,N2F2分子中N原子的杂化方式是_____________,1mol N2F2含有___________个σ键.
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N___Si-N-Si(填“>”“<”或“=”),原因是__________;
II.金属元素在现代工业中也占据极其重要的地位,钛也被称为“未来的钢铁”,具有质轻,抗腐蚀,硬度大,是宇航、航海、化工设备等的理想材料。
(4)基态钛原子核外共有________种运动状态不相同的电子.金属钛晶胞如下图1所示,为_______堆积(填堆积方式).

(5)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2.化合物乙的沸点明显高于化合物甲,主要原因是_____________;化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为_____________;
(6)钙钛矿晶体的结构如图3所示.假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被________个氧离子包围。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:选择题
X的分子式为C5H12O,能与金属钠反应产生氢气,X还能与相对分子质量相同的羧酸Y生成酯Z,则有机物Z有(不含立体异构)( )
A.64种 B.16种 C.8种 D.32种
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三考前热身理综化学试卷(解析版) 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡
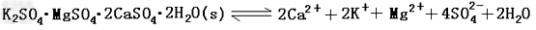
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
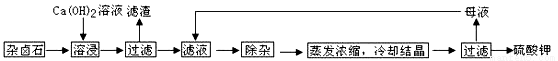
(1)滤渣主要成分有_______和_______以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
____ 。
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入_______溶液调滤液PH至中性。
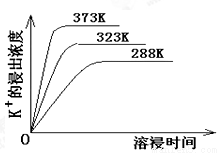
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高,
①________________________②_______________
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
 已知298K时,Ksp(CaCO3)
已知298K时,Ksp(CaCO3)
=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前模拟理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是( )
A.向硫酸铝溶液中加入少量的氨水:Al3++3OH-=Al(OH) 3↓
B.向碳酸钠溶液中加入饱和石灰水:Ca(OH)2 +CO32-=CaCO3↓+2OH-
C.向氢氧化钠溶液中通入过量的氯气:Cl2+2OH-=ClO-+Cl-+H2O
D.向稀硫酸中加入过量铁粉,先后发生两个反应:2Fe+6H+=2Fe3+ +3H2↑,Fe+2Fe3+=3Fe2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
配制一定物质的量浓度的NaOH溶液时,使所配制的溶液浓度偏小的操作是
①烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
②定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线
③实验用的容量瓶洗净后未干燥,里面含有少量水
④定容时俯视
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com