
下列与装置有关的说法正确的是
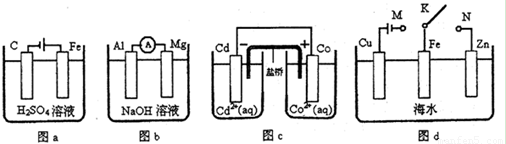
A.图a中,随着电解的进行溶液中H+的浓度越来越大
B.图b中,Mg电极作电池的负极
C.图c中,发生的反应为Co+Cd2+= Cd+Co2+
D.图d中:K分别与M、N连接,Fe电极均受到保护不会腐蚀
D
【解析】
试题分析:A、图a是电解池,铁和电源的正极相连,作阳极,失去电子。碳棒是阴极,溶液中的氢离子在阴极放电,生成氢气,因此随着电解的进行溶液中H+的浓度越来越小,A不正确;B、图b是原电池,Mg的金属性强于铝的金属性,但镁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应,所以铝电极作电池的负极,镁电极是正极,B不正确;C、图c是原电池,根据正负极可知,Cd是负极,失去电子。Co是正极,溶液中的Co2+达到电子,因此发生的反应为Cd+Co2+= Co+Cd2+,C不正确; D、图d中:K分别与M、N连接,Fe电极分别作阴极和正极,所以均受到保护不会腐蚀,D正确,答案选D。
考点:考查原电化学原理的有关判断和应用


科目:高中化学 来源: 题型:
应用化学反应需要研究化学反应的条件、限度和速率。
(1)773 K、固定体积的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中
能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amolH2,平衡时能生成0.1a molCH3OH,反应就具工业应用价值。
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② ②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ ③下列与催化剂有关的说法中,正确的是 (填字母序号)。
④ a.使用催化剂,使反应 CO(g)+2H2(g)CH3OH(g) ΔH>-91kJ·mol-1
⑤ b.使用催化剂,能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡常数K
(2)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图I所示。
①Fe电极作 极(填“阴”或“阳”);
②Ni电极的电极反应式为: 。
(3)欲用下图II装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、 用量及其他影响速率的条件确定之后,可以通过测定
用量及其他影响速率的条件确定之后,可以通过测定
推算反应速率。
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三模拟考试(理综)化学部分 题型:填空题
(16分)应用化学反应需要研究化学反应的条件、限度和速率。
(1)已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10 mL 0.1 mol·L-1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定有 (填序号)。
①含Fe2+,不含Fe3+② 含Fe3+,不含Br-③ 含Fe3+,还含有Br-
(2)773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a
mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a
mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。

①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③下列与催化剂有关的说法中,正确的是 (填字母序号)。
a. 使用催化剂,使反应CO(g)+2H2(g) CH3OH(g) ΔH>-91
kJ·mol-1
CH3OH(g) ΔH>-91
kJ·mol-1
b. 使用催化剂, 能够提高反应物转化率
c. 使用催化剂,不能改变反应的平衡常数K
(3)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。

① Ni作 (填“阴”或“阳”) 极;
②Ni电极的电极反应式为: 。
(4)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:NO-3+4H++3e-→NO+2H2O
①KMnO4、HCl、Fe(NO3)2、CuO、KI五种物质中的 (填化学式)能使上述还原过程发生。
②欲用下图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。

查看答案和解析>>
科目:高中化学 来源: 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com