
(8分)用如图所示的装置进行制取NO实验(已知Cu与HNO3的反应是放热反应)。

(1)在检查装置的气密性后,向试管a中加入10ml 6 mol·l-1稀HNO3和1gCu片,然后立即用带导管的橡皮塞塞紧试管口。请写出Cu与稀HNO3反应的化学方程式:_______________________________________________________。
(2)实验过程中通常在开始反应时反应速率缓慢,随后逐渐加快,这是由于
_________________________________________________;进行一段时间后速率
又逐渐减慢,原因是______________________________________________。
(3)欲较快地制得NO,可采取的措施是_____________。
A、 加热 B、使用铜粉 C、稀释HNO3 D、改用浓HNO3
(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(2)反应放热,使温度升高,反应速率加快;反应一段时间后,硝酸的浓度减小了,反应速率又逐渐减慢。 (3)AB
解析:(1)稀硝酸具有强氧化性,和铜反应生成硝酸铜、NO和水。
(2)影响反应速率的因素一般是温度和浓度等。随反应的进行,浓度是降低的,但反应速率是逐渐加快的,说明在反应过程中,温度升高导致反应速率加快的,即该反应是放热反应。当反应进行到一定程度时,硝酸的浓度降低,此时浓度的影响超过了温度对反应速率的影响,因此反应速率又降低。
(3)根据外界条件对反应速率的影响,要加快反应速率可以通过升高温度,或增大反应物的接触面积。C是稀释硝酸,浓度降低,反应速率降低。浓硝酸和铜反应的还原产物是NO2。所以正确的答案是AB。


科目:高中化学 来源: 题型:
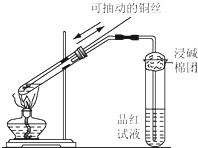 某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
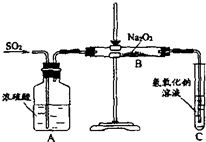
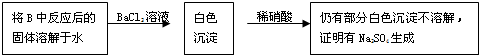
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:| A电极 | B电极 | X溶液 | |
| 甲 | Cu | Zn | H2SO4 |
| 乙 | Pt | Pt | CuCl2 |
| 丙 | Fe | Cu | ? |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示的装置进行电解.A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.则:
用如图所示的装置进行电解.A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.则:
| ||
| ||
| 142w |
| 322(w+0.18) |
| 142w |
| 322(w+0.18) |
查看答案和解析>>
科目:高中化学 来源: 题型:
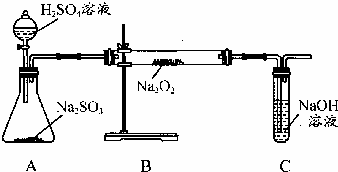 某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题
某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com