
典型金属元素及化合物的特征性质有着重要的应用,请按要求回答:
(1)Na、Al、Fe、Cu四种元素的单质中:
①Al与NaOH溶液反应的离子方程式是____________,其中作氧化剂的是_______。
②Cu在潮湿的空气中被腐蚀的化学方程式是_______________。
(2)上述四种金属的氧化物中:
①写出能用作供氧剂的一个化学方程式:___________________。
②既能溶于酸溶液又溶于强碱溶液,写出溶于强碱溶液的离子方程式_______________。
③常温下为黑色固体的是_________________。
(3)上述四种金属的氢氧化物中:
①易在空气中被氧化的现象是_______________。
②具有两性的是_________________。
(4)上述四种金属形成的阳离子共__________有种,其中既能表现还原性,又能表现氧化性的是__________;其中氧化性最强的是__________。
科目:高中化学 来源: 题型:填空题
 .该方程式的氧化剂为H2SO4;被氧化的元素为Cu.
.该方程式的氧化剂为H2SO4;被氧化的元素为Cu.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验结果随反应物用量改变而改变 | |
| B. | 实验中氢氧化钠溶液稍过量是为了使盐酸完全被氢氧化钠中和 | |
| C. | 实验中不可用环形铜质搅拌棒代替环形玻璃搅拌棒 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:填空题
二水合重重铬酸钠(Na2Cr2O7.2H2O),[已知M(Na2Cr2O7.2H2O)=298g/mol]俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO.Cr2O3,还含有A1203、MgO、Si02等杂质)为主要原料生产,其主要工艺流程如图:
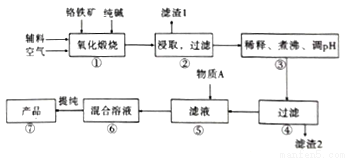
已知信息:
Ⅰ.“①”中涉及的主要反应是:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
Ⅱ.部分阳离子以氢氧化物形式完全沉淀时溶液的PH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液PH | 4.7 | 3.7 | 11.2 | 5.6 |
(1).杂质A12O3、SiO2与纯碱反应转变为可溶性盐,写出A12O3纯碱反应的化学方程式为:______________,滤渣1的主要成分为__________________。
(2).“③”中通过调节PH除去杂质,调节PH至___________。
(3).“⑤”中向滤液中加入物质A,得到Na2Cr2O3和Na2SO4的混合溶液,物质A为__________,简述原因:______________________________。(用离子方程式及文字加以说明)
(4).如图是Na2Cr2O3.2H2O和Na2SO4的溶解度曲线。提纯的实验操作:将Na2Cr2O3和Na2SO4的混合溶液______________________,得到Na2SO4固体和较纯净的Na2Cr2O3溶液。
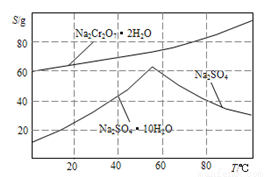
(5).实验室测定所得产品中红矾钠的纯度,称取产品3.2g,配成250mol溶液,取出25.00mL于锥形瓶中,加入10mL2mol/LH2SO4和足量碘化钾,放于暗处5min,写出离子方程式:________________。然后加水100mL,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-若达到滴定终点时,共用去Na2S2O3标准溶液60mL,所得产品的纯度是_________(结果保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA
B.46gNO2和N2O4混合气体中含有原子总数为3NA
C.标准状况下,22.4LSO3中含有的分子数为NA.
D.1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列说法正确的是
①氢氧化铝具有弱碱性,可用于制胃酸中和剂
②铝罐可久盛食醋
③FeCl3溶液可用于铜质印刷线路板制作,该反应是置换反应
④ 将水蒸气通过灼热的铁粉,出现的现象是粉末变红,说明铁与水在高温下发生反应
⑤明矾能水解生成Al(OH)3.胶体,可用作净水剂
⑥Fe与S混合加热生成FeS2
⑦Fe与稀硝酸、稀硫酸反应均有气泡产生,说明Fe与两种酸均发生置换反应
⑧氧化铁能与酸反应,因而可利用于制作红色涂料
A. 1个 B. 2个 C. 3个 D. 5个
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:实验题
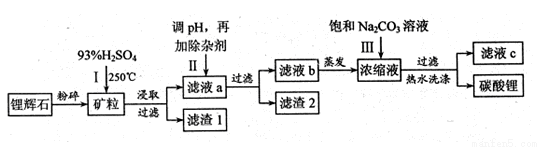
碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制 备Li2CO3的工艺流程如下:
备Li2CO3的工艺流程如下:
已知①2LiAlSi2O6+H2SO4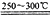 Li2SO4+Al2O3•4SiO2•H2O
Li2SO4+Al2O3•4SiO2•H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
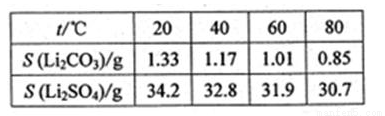
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节 溶液的pH到6.0—6.5,此时沉
溶液的pH到6.0—6.5,此时沉 淀的杂质离子有 ;石灰石调节溶液pH的原理的离子方程式为 。
淀的杂质离子有 ;石灰石调节溶液pH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省琼海市高一上学期第一次月考化学试卷 题型:实验题
分离下列几组混合物,将合适的分离方法的序号填在横线上
(1)分离碘单质与铁粉的混合物_______。
(2)分离水和四氯化碳混合物____。
(3)从硝酸钾和氯化钠的混合溶液中获得硝酸钾_____。
(4)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)混合物______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com