
| A. | 浓硝酸中的HNO3见光会分解,因此有时在实验室看到的浓硝酸呈黄色 | |
| B. | SO2具有漂白性,因此可使溴水褪色 | |
| C. | Na的金属性比Cu强,因此可用Na与CuSO4溶液反应制取Cu | |
| D. | Fe在Cl2中燃烧生成FeCl3,因此在与其他非金属反应的产物中Fe也显+3价 |
分析 A.浓硝酸具有不稳定下,见光分解生成二氧化氮、氧气和水;
B.SO2具有还原性,与溴水发生氧化还原反应;
C.Na投入到CuSO4溶液,先与水发生反应生成氢氧化钠,氢氧化钠再与硫酸铜发生复分解反应;
D.氯气具有强氧化性,而非金属性S具有弱氧化性.
解答 解:A.浓硝酸不稳定,见光分解4HNO3 $\frac{\underline{\;光照\;}}{\;}$4NO2+O2+2H2O,生成二氧化氮,二氧化氮溶于硝酸而使硝酸显黄色,故A正确;
B.SO2的漂白性是和有色有机物结合为不稳定的无色物质,SO2和溴水之间发生氧化还原反应使之褪色,故B错误;
C.Na投入到CuSO4溶液,先与水发生反应生成氢氧化钠,氢氧化钠再与硫酸铜发生复分解反应生成氢氧化铜沉淀,不能发生置换反应,故C错误;
D.氯气具有强氧化性,Fe在Cl2中燃烧生成FeCl3,而非金属性S具有弱氧化性,Fe与S反应生成FeS,产物中的Fe为+2价,故D错误;
故选A.
点评 本题考查物质的性质,综合考查元素化合物性质,为高频考点,把握浓硝酸、二氧化硫、钠、氯气等物质的性质为解答的关键,题目难度不大.


科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在密闭容器里,A与B反应生成C,其反应速率分别用VA、VB、VC表示,已知2VB=3VA、3 VC =2 VB,则此反应可表示为( )
A. 2A+3B=2C B. A+3B=2C C. 3A+B=2C D. A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用BaCl2溶液鉴别Na2CO3和Na2SO4溶液 | |
| B. | 用淀粉溶液检验食盐中是否添加KIO3 | |
| C. | 用焰色反应并透过蓝色钴玻璃检验NaCl中是否混有KCl | |
| D. | 用溴水鉴别乙烯和二氧化硫两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32:18 | B. | 16:11 | C. | 8:11 | D. | 16:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
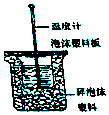 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.| 实验用品 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.3℃ |
| ② | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.5℃ |
| 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 21.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
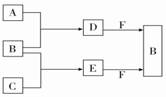 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )| A. | F中阴阳离子个数比为1:1 | |
| B. | 化合物F中既有离子键又有共价键 | |
| C. | 合成过程中的反应均是氧化还原反应 | |
| D. | 1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO全部转化为乙醇 | |
| B. | 断4NA个H-H键的同时,生成46g乙醇 | |
| C. | 若反应在恒温密闭容器中进行,容器中混合气体的密度不再改变 | |
| D. | 若反应在绝热密闭容器中进行,容器中温度不再改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com