
分析 酸性强的酸能制备酸性弱的酸,酸性越强,其电离常数越大,据此分析.
解答 解:①HA+HB-(少量)═A-+H2B,酸性:HA>H2B;
②H2B(少量)+C-═HB-+HC,酸性:H2B>HC>HB-;
③HA(少量)+C-═A-+HC,酸性:HA>HC;
综上可知,酸性:HA>H2B>HC>HB-,酸性越强,弱酸的电离平衡常数越大,所以HA的Ka为1.8×10-5,HC的Ka为4.9×10-10;
故答案为:1.8×10-5;4.9×10-10.
点评 本题考查了弱电解质的电离平衡常数、强酸制弱酸原理,题目难度不大,明确弱酸的电离平衡常数与酸性强弱的关系即可解答,侧重于考查学生对基本原理的理解和应用能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
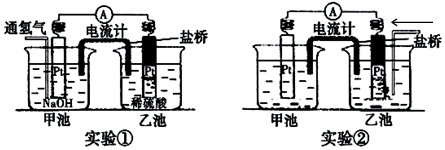
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
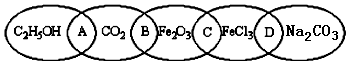
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
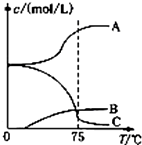 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com