
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A. 元素Y、Z、W形成的简单离子具有相同电子层结构,其半径依次增大
B. 元素Y、R分别与元素X形成的化合物的稳定性:XmY强于XmR
C. 元素Z、Y形成的1mol化合物中含有的分子数约为1.806×1024
D. 元素Z、R的最高价氧化物水化物之间相互反应生成的盐溶液呈中性或碱性
【答案】B
【解析】A项,X是周期表中原子半径最小的元素,应为![]() 元素,Y原子最外层电子数是次外层电子数的3倍,应为
元素,Y原子最外层电子数是次外层电子数的3倍,应为![]() 元素;根据Z、W、R处于同一周期,R与Y处于同一族,则R为
元素;根据Z、W、R处于同一周期,R与Y处于同一族,则R为![]() 元素,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为
元素,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为![]() ,又Z、W、处于同一周期,应为第三周期,分别为
,又Z、W、处于同一周期,应为第三周期,分别为![]() 和
和![]() 元素,从题目所给的条件可以看出X是
元素,从题目所给的条件可以看出X是![]() 元素,Y是
元素,Y是![]() 元素,Z是
元素,Z是![]() 元素,W是
元素,W是![]() 元素,R是
元素,R是![]() 元素,Y、Z、W具有相同电子层结构的离子(
元素,Y、Z、W具有相同电子层结构的离子(![]() ),根据核外电子排布相同的微粒,半径随着核电荷数的增加而减小,故A错误;B元素Y、R分别与元素X形成的化合物是氢化物,因为Y(
),根据核外电子排布相同的微粒,半径随着核电荷数的增加而减小,故A错误;B元素Y、R分别与元素X形成的化合物是氢化物,因为Y(![]() 元素)和R(
元素)和R(![]() 元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:
元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:![]() ,故B正确;C Y为氧,Z为钠,元素Z、Y形成的均为离子化合物,不存在分子,故C错;D项,元素Z、R的氧化物的水化物之间相互反应生成的盐溶液不一定呈中性或碱性,例如硫酸氢钠水溶液显酸性,故D项错误。综上所述,本题正确答案为B。
,故B正确;C Y为氧,Z为钠,元素Z、Y形成的均为离子化合物,不存在分子,故C错;D项,元素Z、R的氧化物的水化物之间相互反应生成的盐溶液不一定呈中性或碱性,例如硫酸氢钠水溶液显酸性,故D项错误。综上所述,本题正确答案为B。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 24 g Mg变为Mg2+时失去的电子数为2 NA
B. 1 mol OH-中含有的电子数为9 NA
C. 常温常压下,22.4 L H2中含有氢分子的个数为NA
D. 1mol / L NaCl溶液中含有钠离子的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B = C +D,6g A和12g B恰好完全反应,生成C和9 g D,则A:C
A. 3:2 B. 1:4
C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键
B. 乳酸有一对对映异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 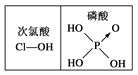
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M2O7x- 与S2-在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+=2M3++3S+7H2O,则x等于________ ,氧化产物与还原产物的物质的量比为_______。
(2)NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合反应的离子方程式_____;
(3)用单线桥标出该反应中电子转移的方向和数目________
Fe3O4 +4CO![]() 3Fe+4CO2
3Fe+4CO2
(4)过量CO2通入NaOH溶液中的离子方程式__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 为原子序数依次增大的四种元素,A2和 B+具有相同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍;D 元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____(填元素符号),其中 C 原子的外围电子排布图为_____.
(2)单质 A 有两种同素异形体,其中沸点高的是_________(填分子式),原因是_____;A 和 B 的氢化 物所含的化学键类型分别为_____和_____.
(3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为_____,中心原子的杂化轨 道类型为_____.
(4)化合物 D2A 的立体构型为_____,中心原子的价层电子对数为_____,单质 D与湿润的 Na2CO3 反应可制备 D2A,其化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知35%NaOH溶液的密度为1.38g·cm-3,5%NaOH溶液的密度为1.05g·cm-3,若将上述两种溶液等体积混合,所得NaOH溶液的质量分数是
A. 大于20% B. 等于20% C. 小于20% D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com