
| A. | 热的纯碱溶液去除油污能力更强 | |
| B. | NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火器 | |
| C. | 保存FeSO4溶液时加入少量铁粉 | |
| D. | 把AlCl3溶液加热蒸干灼烧至质量不再变化得到Al2O3 |
分析 A、盐类的水解是吸热反应;
B、HCO3-与铝离子发生双水解;
C、Fe2+有强还原性,易被氧气氧化;
D、AlCl3在溶液中水解出氢氧化铝和HCl.
解答 解:A、盐类的水解是吸热反应,故升高温度纯碱的水解被促进,水解出的氢氧化钠的浓度更高,则去油污能力更强,和盐类的水解有关,故A错误;
B、HCO3-与铝离子发生双水解生成二氧化碳和氢氧化铝,故可以做泡沫灭火器,和盐类的水解有关,故B错误;
C、Fe2+有强还原性,易被氧气氧化为Fe3+,加入Fe粉后能将还原:2Fe3++Fe=3Fe2+,和盐类的水解无关,故C正确;
D、AlCl3在溶液中水解出氢氧化铝和HCl,而HCl是挥发性酸,加热蒸干时HCl挥发,水解被促进,故会完全水解为氢氧化铝,而灼烧时氢氧化铝会分解为氧化铝,故最终得到的是氧化铝,和盐类的水解有关,故D错误.
故选C.
点评 本题主要考查了盐类水解知识,同时还涉及酯的水解知识,侧重于基础知识的考查,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
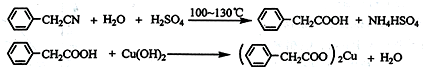
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
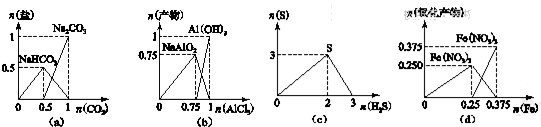
| A. | 图(a):n(NaOH)═1 mol时,CO2和NaOH溶液反应生成的盐 | |
| B. | 图(b):n(NaOH)═3 mol时,AlCl3溶液和NaOH 溶液反应的产物 | |
| C. | 图(c):n(H2S)+n(SO2)═3 mol时,H2S与SO2反应生成的S | |
| D. | 图(d):n(HNO3)═1 mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
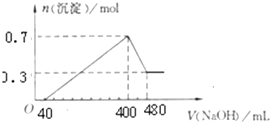 将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系;如图所示.计算:
将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系;如图所示.计算:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳通入过量的氢氧化钠溶液:CO2+2OH-═CO32-+H2O | |
| B. | 碳酸钙与硝酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 少量金属钠放入冷水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com