
| A. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| B. | 酸雨的PH小于5.6 | |
| C. | SO2可以用作食物和干果的防腐剂 | |
| D. | 铵盐受热易分解,都生成氨气和对应的酸 |
分析 A.作为食品的保鲜措施,需选用性质稳定且成本低的物质,氮气来源广泛且性质稳定;
B.正常的雨水中溶解了二氧化碳,二氧化碳和水反应生成碳酸,碳酸电离导致溶液中氢离子浓度大于氢氧根离子浓度而使溶液呈酸性,正常雨水的pH为5.6,如果雨水溶解了二氧化硫、氮氧化物,会使溶液的酸性更强;
C.二氧化硫有毒,据此分析;
D.铵盐受热易分解,但是不一定得到氨气和对应酸;
解答 解:A.填充保护气是向其中充入性质稳定,不能与食品发生反应,无毒无味,并且廉价易得的不能供给呼吸的气体,氮气来源广泛且性质稳定常用作保护气,故A正确;
B.雨水溶解了二氧化硫、氮氧化物,会使溶液的酸性更强,PH小于5.6,称作酸雨,故B正确;
C.二氧化硫是有毒气体可用于漂白,不能用于食品防腐,故C错误;
D.铵盐受热易分解,但是不一定得到氨气和相应的酸,如NH4NO3加热到190℃时分解生成一氧化二氮和水,若加热到300℃左右时分解生成氮气、硝酸和水,故D错误;
故选:CD.
点评 本题考查了物质的性质及用途,把握物质的主要性质即可解答,题目难度不大,注意酸雨的概念.


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
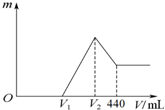
| A. | V2=400mL | |
| B. | 0≤V1<280mL | |
| C. | 加入NaOH溶液的过程中,产生沉淀的最大量可能为0.18mol | |
| D. | 当V1=160mL时,n(Mg)=0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | 温度为298 K时,pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数目为0.5NA | |
| B. | 标准状况下,2.24 L C4H8含有的共用电子对数等于1.1NA | |
| C. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| D. | 27 g Al在标准状况下2.4 L Cl2中燃烧,转的2移的电子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
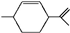 .有关萜二烯的说法不正确的是( )
.有关萜二烯的说法不正确的是( )| A. | 萜二烯的分子式为C10H16,不属于芳香烃 | |
| B. | 可溶于乙醇或乙醚,不溶于水 | |
| C. | 萜二烯分子中所有碳原子处于同一个平面上 | |
| D. | 萜二烯与过量的溴的四氯化碳溶液反应后的产物为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +n HOCH2CH2OH$\stackrel{一定条件}{→}$
+n HOCH2CH2OH$\stackrel{一定条件}{→}$ +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )
如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )| A. | 导线中有电流通过,电流方向是由N到M | |
| B. | N上有气体放出 | |
| C. | M为正极,N为负极 | |
| D. | 是化学能转变为电能的装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com