
 .
.
 ,氯原子核外有17不同运动状态的电子.
,氯原子核外有17不同运动状态的电子. 分析 (1)由浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2,然后来书写氧化还原反应;
(2)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,根据氧化剂和转移电子之间的关系计算;
(3)在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+,说明锰离子被氧化,据此写出离子方程式;
(4)在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(5)上述氧化还原反应体系中,属于第三周期元素硫和氯的简单离子半径,硫离子的核电荷数小于氯;
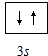
(6)氯原子的最外层电子的轨道式为
 ,氯原子核外有17不同运动状态的电子.
,氯原子核外有17不同运动状态的电子.
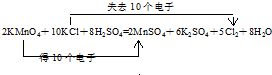
解答 解:(1)由题意可知,高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2,
则反应为KMnO4+KCl+H2SO4→MnSO4+K2SO4+Cl2↑+H2O,由电子守恒及原子守恒可得配平后的化学反应为2KMnO4+10KCl+8H2SO4═2MnSO4+6K2SO4+5Cl2↑+8H2O,
故答案为: ;
;
(2)2KMnO4+10KCl+8H2SO4═2MnSO4+6K2SO4+5Cl2↑+8H2O中,锰元素的化合价由+7变为+2,所以高锰酸钾是氧化剂,2mol氧化剂在反应中在反应中得到电子的物质的量=2mol×(7-2)=10mol,每转移1mol电子,生成Cl2 是0.5mol,体积为11.2L,故答案为:KMnO4;11.2L;
(3)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子,该反应的离子方程式为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O,故答案为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O;
(4)2KMnO4+10KCl+8H2SO4═2MnSO4+6K2SO4+5Cl2↑+8H2O中,高锰酸钾的氧化性大于氯气,2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O中NaBiO3的氧化性大于高锰酸钾,所以氧化性强弱顺序是:NaBiO3>KMnO4>Cl2,故答案为:NaBiO3>KMnO4>Cl2;
(5)上述氧化还原反应体系中,属于第三周期元素硫和氯的简单离子半径,硫离子的核电荷数小于氯,所以S2->Cl-,故答案为:S2->Cl-;
(6)氯原子的最外层电子的轨道式为
 ,氯原子核外有17不同运动状态的电子,
,氯原子核外有17不同运动状态的电子,
故答案为:
 ;17.
;17.
点评 本题考查学生利用物质中元素的化合价变化来分析物质的性质并书写反应方程式,明确元素化合价是解本题关键,难度不大.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 物质 | 分子的价层电子对数 | 中心原子的杂化轨道类型 | 分子的立体构型名称 |
| X2Z | V形 | ||
| YZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②①③ | B. | ①③②④ | C. | ③②④① | D. | ③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 油脂在稀硫酸或氢氧化钠溶液中均可发生水解反应,水解产物相同 | |
| B. | 取淀粉与稀硫酸共热后的溶液,加入新制银氨溶液共热,没有银镜产生,说明淀粉尚未水解生成葡萄糖 | |
| C. | 结构式为如上图所示的有机物,可以在稀硫酸催化下发生水解反应,但水解产物只有一种 | |
| D. | 纤维素、蔗糖、葡萄糖、蛋白质在一定条件下均可发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4 mol/( L•S ) | B. | v(C)=30 mol/( L•min ) | ||
| C. | v(B)=36 mol/( L•min ) | D. | v(A)=0.15 mol/( L•S ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com