
| A. | 使酚酞试剂变红的溶液中:Na+、Cu2+、Cl-、NO3 | |
| B. | 使Al产生H2的溶液中:Na+、Ba2+、C1-、HCO3- | |
| C. | 透明溶液中:Mg2+、Fe3+、Cl-、SO42- | |
| D. | 含有 ClO- 的溶液中:K+、Fe2+、Cl-、SO42-. |
分析 A.使酚酞试剂变红的溶液,显碱性;
B.使Al产生H2的溶液,为非氧化性酸或强碱溶液;
C.该组离子之间不反应;
D.离子之间发生氧化还原反应.
解答 解:A.使酚酞试剂变红的溶液,显碱性,不能大量存在Cu2+,故A不选;
B.使Al产生H2的溶液,为非氧化性酸或强碱溶液,酸碱溶液均不能大量存在HCO3-,故B不选;
C.该组离子之间不反应,可大量共存,故C选;
D.Fe2+、ClO-发生氧化还原反应,不能共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
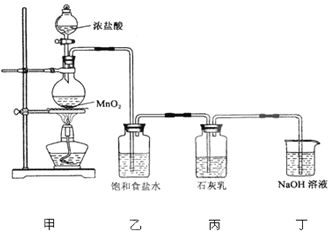
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )
锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )| A. | 氧气在石墨电极上发生氧化反应 | |
| B. | 该电池的负极反应为Zn+H2O-2e-=ZnO+2H+ | |
| C. | 该电池放电时OH-向石墨电极移动 | |
| D. | 该电池充电时应将Zn电极与电源负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeC13溶液中:A13+、NH4+、Cl-、SCN- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、K+、SO42-、NO3- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-15mol/L的溶液中:Na+、Fe3+、I-、AlO2- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不只是酸、碱、盐类物质才属于电解质 | |
| B. | 氯化钠溶液在电流作用下电离为钠离子与氯离子 | |
| C. | 电解质未必能导电,能导电的也未必是电解质 | |
| D. | 硫酸钡的水溶液虽导电性极弱,但硫酸钡是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是一样的 | |
| C. | MgO和Al2O3在工业上用于制作耐高温材料,可用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
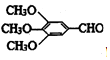 )和抗癫痫药物H(
)和抗癫痫药物H(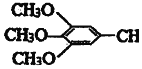 =CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):
=CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):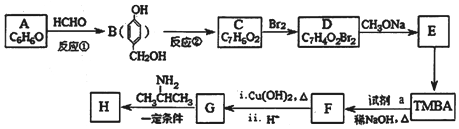
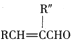 (R、R″表示烃基或氢)
(R、R″表示烃基或氢)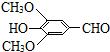 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O.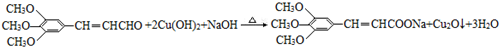 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K +、.MnO 4 -、Cl -、SO 4 2- | B. | Na +、CO 3 2-、Cl -、SO 4 2- | ||
| C. | NO 3 -、Na +、HCO 3 -、Ba 2+ | D. | Na +、NO 3 -、NH 4 +、SO 4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com