
(7分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
形成的化合物 甲 乙 丙 丁 戊
化合物中各元素的原子个数比 A:C=2:1 B:A=1:3 D:C=1:1 E:F=1:3 A:F=1:1
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,B的最高价氧化物的水化物的化学式为 。
③向丙物质中滴加甲的化学反应方程式为 。
(1)Si3N4(2分) (2) ①第三周期第VII族(1分)② (1分) HNO3(1分)
(1分) HNO3(1分)
③2Na2O2+2H2O=4NaOH+O2↑(2分)
【解析】
试题分析:(1)氮元素的的非金属性强于Si元素,其中氮元素的最低价是-3价,Si的最高价是+4价,所以氮化硅的化学式为Si3N4。
(2)B原子最外层电子数比次外层电子数多3个,则B是氮元素。C原子的最外层电子数是次外层电子数的3倍,所以C是氧元素。根据甲中原子个数之比可知,A是氢元素,甲是水,乙是氨气。D、A同主族,所以根据原子序数大小顺序可知,D是Na元素,则丙是过氧化钠。D、E、F同周期,且E与F的原子序数之和为30,所以E是Al,F是Cl,丁是AlCl3,戊是HCl。
考点:考查元素周期表的结构和元素周期律的应用
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重考查学生的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


科目:高中化学 来源: 题型:
(10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,乙的电子式为 ,丙的电子式为 ,B的最高价氧化物的水化物的化学式为 。
③向甲的水溶液中加入,反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年山东省聊城四中高一第二学期期末考试化学试题 题型:填空题
(10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
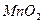 ,反应的化学方程式为 。
,反应的化学方程式为 。查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省集贤县第一中学高二上学期期末考试化学试卷(带解析) 题型:填空题
(7分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=2:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
查看答案和解析>>
科目:高中化学 来源:2010年山东省高一第二学期期末考试化学试题 题型:填空题
(10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
|
形成的化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
|
化合物中各元素的原子个数比 |
A:C=1:1 |
B:A=1:3 |
D:C=1:1 |
E:F=1:3 |
A:F=1:1 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,乙的电子式为 ,丙的电子式为 ,B的最高价氧化物的水化物的化学式为 。
③向甲的水溶液中加入 ,反应的化学方程式为
。
,反应的化学方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com