
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
| 1 |
| 10 |
| 1 |
| 10 |
| n |
| V |
| 4.137g |
| 197g/mol |
| 1 |
| 10 |
| 0.005mol |
| 0.5L |


科目:高中化学 来源: 题型:
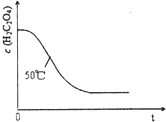
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑ |
| B、阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑ |
| C、阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2↑ |
| D、阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、购物时自带环保购物袋或竹篮 |
| B、大力发展清洁能源,如太阳能、氢能、风能等等 |
| C、出门尽量步行或者乘坐公交车,少开私家车 |
| D、随意丢弃废旧电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、④⑤ |
| C、③④⑦ | D、③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、存在0.5 mol的CO |
| B、存在0.125 mol的O2 |
| C、存在0.25 mol的Na2CO3 |
| D、存在1.25 mol的Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com