
分析 水的密度为1g/mL,据此求出1g水的体积,然后根据在25℃时,水的离子积Kw=c(H+)c(OH-)=10-14,而由于纯水显中性,故有c(H+)=c(OH-)=10-7,即可求出1mL水中氢离子的物质的量,继而能求出个数,据此分析.
解答 解:水的密度为1g/mL,故1g水的体积为1mL,即10-3L.
在25℃时,水的离子积Kw=c(H+)c(OH-)=10-14,而由于纯水显中性,故有c(H+)=c(OH-)=10-7mol/L.
故10-3L水中含有的氢离子的物质的量n=CV=10-7mol/L×10-3L=10-10mol,个数N=nNA=10-10NA.
故答案为:10-10.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | Cu→A | -0.15 |
| B | B→Cu | +0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+) | |
| B. | x=20时溶液导电能力比x=15时溶液导电能力强 | |
| C. | x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-) | |
| D. | x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 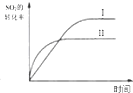 研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. | 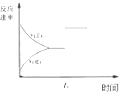 图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 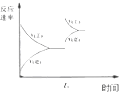 图中t0时增大压强,使平衡向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中阳离子总数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 将乙醇与浓硫酸共热至l70℃,所得气体通入酸性KMnO4溶液中 | 酸性KMnO4溶液褪色 | 乙醇发生消去反应,气体中只含有乙烯 |
| B | 淀粉溶液和稀H2SO4混合加热,加新制Cu(OH)2悬浊液加热至沸腾 | 有砖红色沉淀产生 | 淀粉发生水解,产物有还原性 |
| C | 向甲苯中滴入适量浓溴水,振荡,静置 | 溶液上层呈橙红色, 下层几乎无色 | 甲苯和溴发生取代反应,使溴水褪色 |
| D | 在洁净的试管中加入2%硝酸银溶液1mL,逐滴加入2%稀氨水至沉淀恰好溶解为止,再滴加几滴乙醛,振荡后,放入热水浴中加热 | 试管壁出现光亮的银镜 | 乙醛发生了氧化反应,乙醛有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com