
【题目】苯酚![]() 在一定条件下能与H2加成得到环己醇
在一定条件下能与H2加成得到环己醇![]() 。下面关于这两种物质的叙述中,错误的是
。下面关于这两种物质的叙述中,错误的是
A. 常温时在水中的溶解性都比乙醇差
B. 都能与金属Na、K等金属反应放出氢气
C. 都显弱酸性,且酸性都弱于碳酸
D. 苯酚与FeCl3溶液作用显紫色,环己醇加入FeCl3溶液,液体分层,上层无色
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
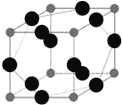
【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
W | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______.
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”) .
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示).
(4)Na在Y2中燃烧产物的电子式为________________.
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体.
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单一盐溶液中离子浓度比较
(1)NH4Cl溶液中存在的水解平衡是________,使c(H+)___c(OH-)、c(Cl-)_____c(NH4+),盐类的水解是很微弱的,所以溶液中剩余未水解的NH4+的浓度_______水解产生的OH-的浓度。所以溶液中离子浓度大小关系是________。
(2)Na2CO3溶液中存在的水解平衡是__________、_______离子浓度大小关系是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W是合成一种抗心律失常药物的中间物质,一种合成该物质的路线如下:
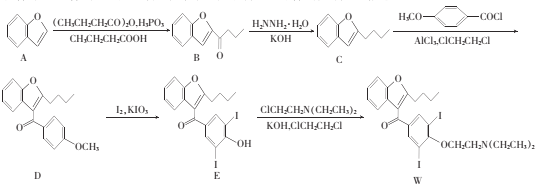
(1)ClCH2CH2Cl的名称是____。
(2)E中不含氧的官能团的名称为___ 。
(3)C的分子式为____,B—C的反应类型是___
(4)筛选C—D的最优反应条件(各组别条件得到的D的产率不同)如下表所示:
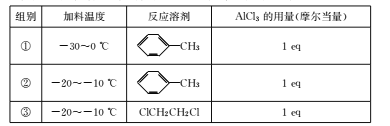
上述实验筛选了____和 ___对物质D产率的影响。此外还可以进一步探究____对物质D产率的影响。
(5)M为A的同分异构体,写出满足下列条件的M的结构简式:___ 。
①除苯环外不含其他环;②有四种不同化学环境的氢,个数比为1:1:2:2;③l mol M只能与1 molNaOH反应。
(6)结合上述合成路线,写出以![]() 和SOCl2为基本原料合成
和SOCl2为基本原料合成![]() 的路线图。(其他所需无机试剂及溶剂任选)___已知:
的路线图。(其他所需无机试剂及溶剂任选)___已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1mol某烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4L,同时得到16.2g水。
(1)该烃的摩尔质量为______________。
(2)该烃的分子式为____________________。
(3)该烃有一种可能的结构为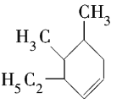 ,其系统命名为___________。
,其系统命名为___________。
(4) 属于______________(选填序号)。
属于______________(选填序号)。
a.环烃b.烷烃c.芳香烃d.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的某有机物3.24 g装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管(A)和碱石灰干燥管(B)。测得A管增重2.16 g,B管增重9.24 g。已知有机物的相对分子质量为108。
(1)燃烧此化合物3.24 g,须消耗的氧气的质量是多少?__________
(2)求此化合物的分子式。__________
(3)该化合物1分子中存在1个苯环和1个羟基,试写出其同分异构体的结构简式和名称。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(分子式C8H8O3)为无色液体,难溶于水,有特殊香味。从A出发,可发生如下图所示的一系列反应,图中的化合物A硝化时可生成四种一硝基取代物,化合物H的分子式为C6H6O,G能发生银镜反应。

回答下列问题:
(1)写出下列化合物可能的结构简式:
A________,E_______,K ________。
(2)反应类型(Ⅰ)________,(Ⅱ)________,(Ⅲ)_______。
(3)反应方程式:H―→K_________,C+F―→_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是 ( )
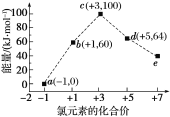
A. e是ClO3-
B. b→a+c反应的活化能为60 kJ·mol-1
C. a、b、c、d、e中c最稳定
D. b→a+d反应的热化学方程式为3ClO-(aq)===ClO3- (aq)+2Cl-(aq)ΔH=-116 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内试剂均足量,部分夹持装置已省略)。
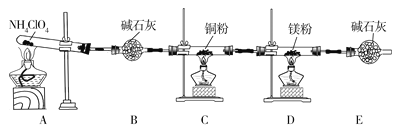
(1)在实验过程中发现C中铜粉由红色变为黑色,说明分解产物中有__(填化学式)。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为__。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是__。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
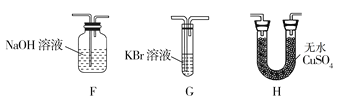
①按气流从左至右,装置的连接顺序为A→__→__→__。
②F中发生反应的离子方程式为__。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为___。
(6)在实验过程中仪器E中装有碱石灰的目的__;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__(填“偏大”“偏小”或“无法判断”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com