
【题目】下列说法错误的是
A.用水鉴别乙醇、苯和溴苯
B.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C.橡胶、蛋白质、尼龙、纤维素都是天然高分子化合物
D.通常所说的三大合成材料是指塑料、合成纤维和合成橡胶
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574.0kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2 (g)+2H2O(g) △H=-1160.0 kJ/mol
③H2O(g)=H2O(1) △H=-44.0 kJ/mol
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(的热化学方程式是__________________。
(2)已知2NO(g)+O2(g)![]() 2 NO2(g)的反应历程分两步:
2 NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g)![]() 2 NO2(g) (慢) v2正=k2正·c (N2O2)·c(O2), v2逆=k2逆·c 2(NO2)
2 NO2(g) (慢) v2正=k2正·c (N2O2)·c(O2), v2逆=k2逆·c 2(NO2)
一定温度下,反应2NO(g)+O2(g)![]() 2 NO2(g)达到平衡状态,该反应的平衡常数的表达式K=______________________(用k1正、k1正、k2逆、k2逆表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)
2 NO2(g)达到平衡状态,该反应的平衡常数的表达式K=______________________(用k1正、k1正、k2逆、k2逆表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:

①T℃时,该反应的平衡常数为___________(保留两位有效数字)
②在31min时,若只改变某一条件使平衡发生移动,40min、50min时各物质的浓度如上表所示,则改变的条件是______________________。
③在51min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡___________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应N2O4(g)![]() 2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(N2O2)=k1·p(N2O4),v(NO2)=k2·p2(NO2)其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(N2O2)=k1·p(N2O4),v(NO2)=k2·p2(NO2)其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。

在T℃时,图中M、N点能表示该反应达到平衡状态,理由是______________________。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙苯制备苯乙烯的反应为:![]()
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/KJ/mol | 412 | 348 | 612 | 436 |
下列说法错误的是
A. 上述反应的△H=+124kJmol﹣1 B. 乙苯比苯乙烯稳定
C. 乙苯中不存在碳碳双键 D. 1mol乙苯的能量与1mol苯乙烯能量相差264kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
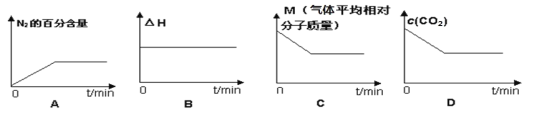
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药——羟苯水杨胺,其合成路线如下。回答下列问题:

已知:
(1)羟苯水杨胺的化学式为________。对于羟苯水杨胺,下列说法正确的是_______。
A.1mol羟苯水杨胺最多可以和2 molNaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
(2)D的名称为___________。
(3)A→B所需试剂为___________;A→B反应的有机反应类型是___________。
(4)B→C反应的化学方程式为_____________________。
(5)F存在多种同分异构体。
①F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
②F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的物质共有______种;写出其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式_______。(写出一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
A. 用物质A表示反应的平均速率为0.3 mol·L-1·s-1
B. 用物质B表示反应的平均速率为0.3 mol·L-1·s-1
C. 2 s时物质A的转化率为70%
D. 2 s时物质B的浓度为0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在恒容密闭容器中,反应2NO2 (g) ![]() N2O4(g) (正反应为放热反应)在一定条件下达到平衡,升高温度容器中气体颜色_____,向容器通人一定量的氦气容器中气体颜色_____。
N2O4(g) (正反应为放热反应)在一定条件下达到平衡,升高温度容器中气体颜色_____,向容器通人一定量的氦气容器中气体颜色_____。
(2)在一定条件下,可逆反应:mA+nB![]() 1/2pC达到平衡,若:
1/2pC达到平衡,若:
①A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是_____。
②A、C是气体,增加B的量,平衡不移动,则B为______________。
③A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是__________。(正向或逆向)
④加热后,可使C的质量增加,则正反应是____________反应(放热或吸热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.5 mol·L-1硫酸溶液450 mL。根据溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制450 mL、0.5 mol·L-1的稀硫酸。计算所需浓硫酸的体积为________ mL(保留1位小数),现有
①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________________________________________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→________→ ________→________→________→④(填序号)。_________
(5)在配制过程中,其他操作都准确,下列操作中错误的是________(填代号,下同),能引起误差偏高的有________。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com