
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
科目:高中化学 来源: 题型:
【题目】某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现下图所示的物质之间的转化:
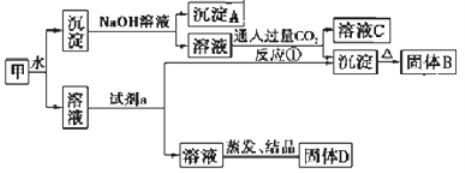
请回答下列问题:
(1)写出A、B的化学式:A__________,B__________。
(2)试剂a最好选用下列试剂中的______________。
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式_____________________________________。
(3)写出反应①(生成溶液C和沉淀)的离子方程式______________。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
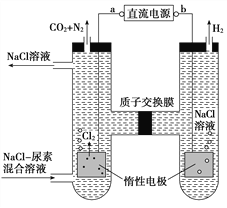
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是

A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3电离平衡常数Ka1≈10-6
C. pH=7时,溶液中存在关系c(HCO![]() )>c(H2CO3)>c(CO
)>c(H2CO3)>c(CO![]() )
)
D. pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
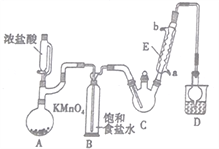
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是____________,冷凝水的流向是________进_______出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________,引起的后果是_________________。
(3)仪器A中发生反应的离子方程式为____________________。
(4)该装置C可采用_______________,加热的方法以控制反应温度在70℃左右。
(5)装置D干燥管的作用为_______________,装置D烧杯中的试剂是_______________。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________(填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为合成氨反应(N2+ 3H2![]() 2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是
2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是

A. 温度(T/K) B. 压强(P/Pa)
C. 反应时间(t/min) D. 氮气浓度(c/mol·L―1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将3 molCO2和2 mol H2混合于2 L恒容密闭容器中,发生如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。回答下列问题:
CO(g)+H2O(g)。回答下列问题:
(1)该反应的化学平衡常数表达式K=__________________________。
(2)已知700℃时,该反应的平衡常数K1=0.60,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
的平衡常数K2=____________,反应![]() CO2(g)+
CO2(g)+ ![]() H2(g)
H2(g)![]()
![]() CO(g)+
CO(g)+ ![]() H2O(g)的平衡常数K3=___________。
H2O(g)的平衡常数K3=___________。
(3)已知在1000℃时,该反应的平衡常数K4=1.0,则该反应为_________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是____________(填标号)。
a. 容器中压强不变 b.c(CO2)=c(CO)
c.CO2的生成速率等于H2的消耗速率 d.混合气体的平均相对分子质量不变
(5)在1000℃下,将3 molCO2和2 mol H2混合于2 L恒容密闭容器中,发生如下反应:CO2(g)+ H2(g)![]() CO(g)+ H2O(g),某时刻CO2的物质的量为2.0 mol,则此时v(正)__________v(逆) (填“>”“<”或“=”);该温度下反应达到平衡时,CO2的转化率为____________________。
CO(g)+ H2O(g),某时刻CO2的物质的量为2.0 mol,则此时v(正)__________v(逆) (填“>”“<”或“=”);该温度下反应达到平衡时,CO2的转化率为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com