
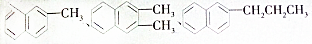 都属于萘(结构简式:
都属于萘(结构简式: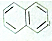 的同系物,则萘和萘的同系物分子组成通式是( )
的同系物,则萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-12(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 着色剂---胡萝卜素、苯甲酸钠 | B. | 调味剂---亚硝酸钠、味精 | ||
| C. | 防腐剂---氯化钠、柠檬黄 | D. | 营养强化剂---酱油中加铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素间形成的化学键都是共价键 | |
| B. | 第三周期主族元素的最高正化合价等于它所处的族序数 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 最外层电子数相同的原子属于同一族且化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
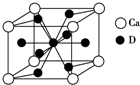 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
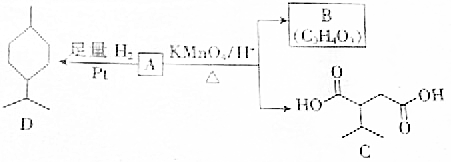
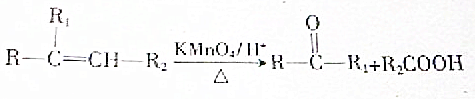
 .A与等物质量的溴单质反应的产物有3种.
.A与等物质量的溴单质反应的产物有3种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
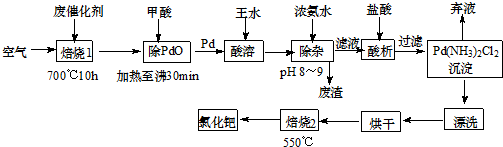
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
| 进料液 | 0.30 | 310 |
| 电解后 | 0.32 | 210 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
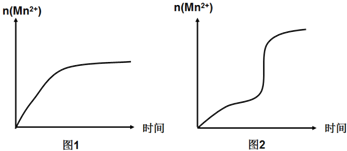
| 实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com