
【题目】利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠。下列叙述正确的是

A. a气体为氢气,b气体为氧气
B. A为氢氧化钠溶液,B为硫酸溶液
C. 通电后中问隔室的SO42-向阴极迁移,阳极区溶液的pH增大
D. 该电解反应的方程式为2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
【答案】D
【解析】A.在阳极氢氧根离子放电生成氧气,在阴极氢离子放电生成氢气,所以a气体为氧气,b气体为氢气,故A错误;B.在阳极氢氧根离子放电生成氧气,同时生成氢离子,所以阳极生成硫酸,即A溶液为硫酸;在阴极氢离子放电生成氢气,同时生成氢氧根离子,所以阴极生成NaOH,即B溶液为氢氧化钠,故B错误;C.阴离子透过c隔膜向阳极移动,在阳极氢氧根离子放电生成氧气,同时生成氢离子,所以阳极生成硫酸,溶液的pH降低,故C错误;D.在阳极氢氧根离子放电生成氧气,在阴极氢离子放电生成氢气,所以该电解反应的总方程式为2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑,故D正确;故选D。
2H2SO4+4NaOH+O2↑+2H2↑,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】如图是制取溴苯的装置,先向分液漏斗中加入苯和液溴,再打开活塞将混合物慢慢滴入A中.试回答:

(1)装置A中发生反应的化学方程式___________。
(2)C中盛放CCl4的作用是___________。
(3)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入 ________,根据产生___________________________(填现象) ,则能证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体,在同温同压下,两容器中的气体一定具有相同的( )
A.原子数
B.密度
C.质量
D.H的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在固定容积的密闭容器中反应,达到平衡状态的标志是( )
在固定容积的密闭容器中反应,达到平衡状态的标志是( )
(1)单位时间内生成![]() 的同时生成
的同时生成![]()
(2)单位时间内生成![]() 的同时生成
的同时生成![]()
(3)用![]() 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
A.(1)(4) B.(2)(3) C.(1)(3)(4) D.(1)(2)(3)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙炔制取的说法不正确的是
A. 反应后溶液呈碱性
B. 此反应是放热反应
C. 为了除去杂质气体,可用硫酸铜溶液
D. 为了加快反应速率可用饱和食盐水代替水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知水在25℃和95℃时,其电离平衡曲线如图所示。

(1)则95℃时水的电离平衡曲线应为_____(填“A”或“B”),理由是_____。
(2)曲线A对应温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用a1、a2表示,则a1________ a2 (填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的PH ______7。
(3)在曲线B所对应的温度下,将0.02mol·L-1的Ba (OH)2溶液与等物质的量浓度的NaHSO4 溶液等体积混合,所得混合液的PH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是

A. 两步反应的ΔH均大于0 B. 加入催化剂能改变反应的焓变
C. 三种物质中C最稳定 D. A→C反应的ΔH=E4-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,向相同浓度的醋酸和盐酸中分别加入NaOH溶液,其pH与加入的NaOH溶液的体积变化关系分别如下图I、II所示。室温下,将xmol/L盐酸滴入VmLymol/L的碱溶液中,溶液pH和温度随加入盐酸体积变化曲线如下图III所示。
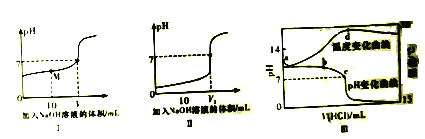
下列说法正确的是
A. 该碱溶液可能是Ba(OH)2溶液
B. c、d两点对应的盐酸体积不同
C. 从图中可判断x约为1, y小于1
D. d点后温度降低,是因为生成的盐发生水解吸热所致
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com