
| A.1:2 | B.2:5 | C.3:2 | D.4:1 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.Cu、Fe3+、Fe | B.Fe2+、Fe3+、Fe |
| C.Cu、Cu2+、Fe | D.Cu、Fe2+、Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物总质量为13.6 g |
| C.反应后的固体混合物中氧化物的物质的量为0.05 mol |
| D.反应后的固体混合物中单质Cu的质量为12.8 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
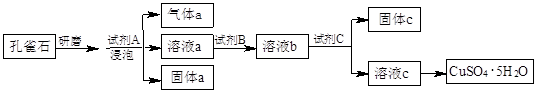
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯水和氯化亚铁溶液 | B.铁屑和氯化铜溶液 |
| C.铁屑和过量稀硫酸 | D.过量铁屑和氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
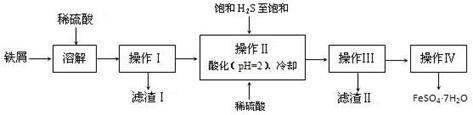
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
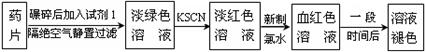
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | | |
| | | |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
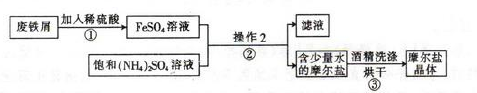
| A.酚酞 | B.石蕊 | C.甲基橙 | D.不需要 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com