
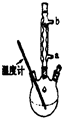
 ����ˮ�����׳ư�˾ƥ�֣�
����ˮ�����׳ư�˾ƥ�֣�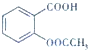 ������������Ӧ����㷺�Ľ��ȡ���ʹ�Ϳ���ҩ������ˮ���������ֽ⣬�ֽ��¶�Ϊ128�桫135�森ʵ������ˮ���ᣨ���ǻ������ᣩ�������[��CH3CO��2O]Ϊ��Ҫԭ�Ϻϳɰ�˾ƥ�֣����Ʊ�ԭ��Ϊ��
������������Ӧ����㷺�Ľ��ȡ���ʹ�Ϳ���ҩ������ˮ���������ֽ⣬�ֽ��¶�Ϊ128�桫135�森ʵ������ˮ���ᣨ���ǻ������ᣩ�������[��CH3CO��2O]Ϊ��Ҫԭ�Ϻϳɰ�˾ƥ�֣����Ʊ�ԭ��Ϊ��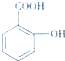 +��CH3CO��2O
+��CH3CO��2O| Ũ���� |
| 85��-90�� |
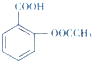 +CH3COOH
+CH3COOH| Ũ���� |
| ҡ�� |
| 85��-90����� |
| ��ȴ |
| ��ѹ���� |
| ϴ�� |
| ���� | ��Է������� | �۵��е㣨�棩 | ˮ |
| ˮ���� | 138 | 158���۵㣩 | �� |
| ������ | 102 | 139.4���е㣩 | ��Ӧ |
| ����ˮ���� | 180 | 135���۵㣩 | �� |
| �������� |
| ��ʯ |
| ���� |
| ���� |
| ���ȹ��� |
| ��ȴ |
| ��ѹ���� |
| ϴ�� |
| ���� |
| 2.0g |
| 138g/mol |
| 5.0ml��1.08g/ml |
| 102g/mol |
| 2.2g |
| 0.0145mol��180g/mol |


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
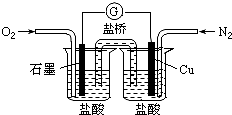 ������ijУʵ��С����Ƶ�һ��ԭ���װ�ã������й���������ȷ���ǣ�������
������ijУʵ��С����Ƶ�һ��ԭ���װ�ã������й���������ȷ���ǣ�������| A����װ���ܽ���ѧ��ת��Ϊ���� |
| B��ʯī�缫�ķ�Ӧʽ��O2+2H2O+4e-=4OH- |
| C��������Cu�缫����������ʯī�缫 |
| D������ܵķ�Ӧ�ǣ�2Cu+O2+4HCl=2CuCl2+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ϡ���� |
B��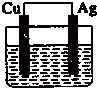 CuSO4��Һ |
C�� AgNO3 |
D��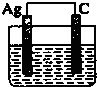 CuSO4��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com