

 );下列试剂能与甲反应而褪色的是AC(填标号)
);下列试剂能与甲反应而褪色的是AC(填标号)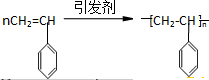 .
. 分析 (1)甲中含C=C和-COOC-,含C=C能发生加成和氧化反应;
(2)淀粉水解生成A为一种单糖,应为葡萄糖,B可发生消去反应,为CH3CH2OH,C为B的消去反应产物,应为CH2=CH2,与X发生加成反应生成D为CH2BrCH2Br,X为溴水或溴的四氯化碳溶液,在碱性条件下水解可生成CH2OHCH2OH;
(3)丙分子中含有1个苯环、1个碳碳双键,1mol丙最多能够消耗4mol氢气;苯乙烯发生加聚反应生成聚苯乙烯.
解答 解:(1)甲中含C=C和-COOC-,不含氧官能团为碳碳双键(或 );含C=C能发生加成和氧化反应,与AC中物质反应褪色,
);含C=C能发生加成和氧化反应,与AC中物质反应褪色,
故答案为:碳碳双键(或 );AC;
);AC;
(2淀粉水解生成A为一种单糖,应为葡萄糖,B可发生消去反应,为CH3CH2OH,C为B的消去反应产物,应为CH2=CH2,C与X发生加成反应生成D为CH2BrCH2Br,X为溴水或溴的四氯化碳溶液,在碱性条件下水解可生成CH2OHCH2OH,
则A的化学式是:C6H12O6,C→D的反应类型是加成反应,
故答案为:C6H12O6;加成反应;
(3)1mol丙分子中含有1mol苯环、1mol碳碳双键,所以1mol丙与氢气发生加成反应能够消耗4mol氢气;苯乙烯中含有碳碳双键,能够发生加聚反应,反应方程式为: ,
,
故答案为:4; .
.
点评 本题考查了有机物推断及结构与性质,为高频考点,题目难度中等,注意掌握常见的有机物的官能团与性质的关系为解答的关键,侧重有机物推断及有机反应类型的考查.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能酸性高锰酸钾溶液褪色 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应为可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此法的优点之一是原料丰富 | |
| B. | 进行①②③步操作的目的是从海水中富集氯化镁 | |
| C. | 第④步电解时会产生氯气 | |
| D. | 以上过程中涉及的反应有分解反应、化合反应、复分解反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
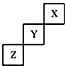
| A. | Y的单质的熔点比Z的低 | |
| B. | Y的最高正化合价为+5 | |
| C. | Z的氢化物的稳定性比Y的强 | |
| D. | X、Y、Z三种元素中,单质在常温下均为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
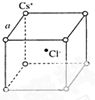 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com