
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在导管口处点燃 | B. | 通入足量高锰酸钾溶液中 | ||
| C. | 通入足量溴水中 | D. | 在一定条件下与H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
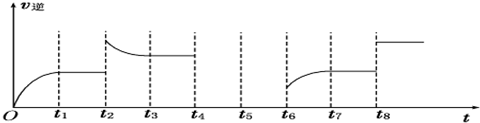
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
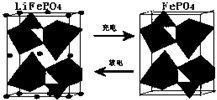
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ/mol | |
| B. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

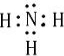 .
.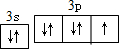 ,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com