
 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.分析 ①称取约2.5000g叠氮化钠试样,配成250mL溶液,需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有,250mL容量瓶、胶头滴管.
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol•L-1(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应).
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+=Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL.
(1)溶液配制的实验过程和步骤分析需要的仪器;
(2)叠氮化钠受撞击时生成两种单质为氮气和钠;
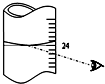
(3)读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按右图图示读取,读数增大,计算过程中剩余铈离子物质的量增大,则叠氮化钠的物质的量减小;
(4)计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸铁红为Ce4+,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算.
解答 解:(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有,250mL容量瓶、胶头滴管;
故答案为:250mL容量瓶、胶头滴管;
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为:2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;
故答案为:2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;
(3)读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按右图图示读取,读数增大,计算过程中剩余铈离子物质的量增大,则叠氮化钠的物质的量减小;
故答案为:偏小;
(4)计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸铁红为Ce4+,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算;
n[(NH4)2Ce(NO3)6]=0.1000mol•L-1×50.00×10-3L=5.000×10-3mol
n[(NH4)2Fe(SO4)2]=0.0500mol•L-1×24.00×10-3L=1.200×10-3molw
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.000×10-3mol-1.200×10-3mol
=3.800×10-3mol
ω=$\frac{3.800×1{0}^{-3}mol×65g/mol}{2.5000g×\frac{25.00ml}{250.00ml}}$×100%=98.80%;
答:叠氮化钠试样中含NaN3的质量分数为98.80%.
点评 本题考查了物质组成的实验探究和定量测定方法,过程分析判断,主要是试剂反应过程的理解应用,掌握基础是关键,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | Y的阳离子半径比W的阴离子半径小 | |
| B. | 气态氢化物的稳定性:X<Z<W | |
| C. | X、Z、W的氧化物对应的水化物的酸性强弱:X<Z<W | |
| D. | 室温下,含Y元素的盐形成的水溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
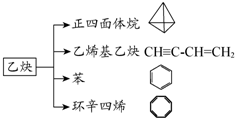 乙炔是一种重要的有机合成原料,以乙炔为原料在不同的反应条件下可以转化成如图所示的各种有机化合物.请回答下列问题:
乙炔是一种重要的有机合成原料,以乙炔为原料在不同的反应条件下可以转化成如图所示的各种有机化合物.请回答下列问题: -CH=CH2、
-CH=CH2、 的反应为取代反应
的反应为取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| D. | pH=11的溶液中:CO32-、Na+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol H2SO4 | |
| B. | 1 L溶液中含有1 mol H+ | |
| C. | 将98 g H2SO4溶于1 L水中配成溶液 | |
| D. | 1 L H2SO4溶液中含98 g H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、Na2O2都属于过氧化物,都存在非极性共价键 | |
| B. | 1mol H2O2在参加反应时可能转移lmol或2mol电子 | |
| C. | H2O2在酶作用下催化分解,随着温度的升高,分解速率持续加快 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、与SO2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

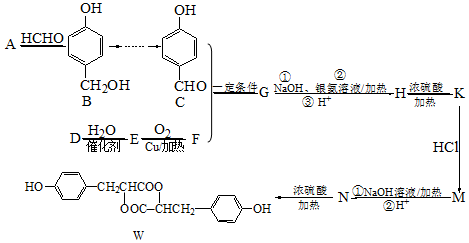
 .
.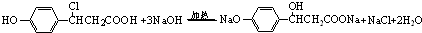 .
.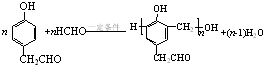 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
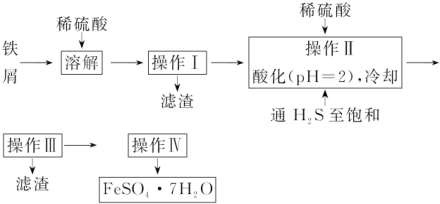
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com