

分析 合金与硝酸剧烈反应,放出红棕色气体X就为NO2,和蓝绿色溶液Y,溶液中应含有铜离子,若将少量Y滴入NaCl溶液中,只产生白色沉淀,则Y中应含有有银离子,氯元素是17号元素,有三个电子层,最外层有7个电子,二氧化硫与二氧化氮发生氧化还原反应,据此答题.
解答 解:合金与硝酸剧烈反应,放出红棕色气体X就为NO2,和蓝绿色溶液Y,溶液中应含有铜离子,若将少量Y滴入NaCl溶液中,只产生白色沉淀,则Y中应含有有银离子,氯元素是17号元素,有三个电子层,最外层有7个电子,亚硫酸氢根与二氧化氮发生氧化还原反应,
(1)氯元素在周期表中的位置是第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)根据上面的分析可知,组成合金的金属是Cu、Ag,故选D;
(3)氨水可以将SO2和NO2同时吸收处理,二氧化硫与氨水反应生成亚硫酸氢根离子,NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+,
故答案为:2NO2+4HSO3-=N2+4SO42-+4H+.
点评 本题主要考查了元素周期表、常见金属的性质、氧化还原反应离子方程式,难度不大,注意根据物质的性质进行物质推断,注重对基础知识的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl-CH2-CH2-OH | B. | Cl-CH2-CHO | C. | HCOOCH2Cl | D. | HO-CH2-CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
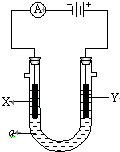 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
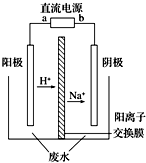 最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 电解过程中,阴极区消耗Na+ | |
| B. | 阳极反应为CH3CHO-2e-+2H+═CH3COOH+H2O | |
| C. | 电解的总反应方程式为2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3COOH+CH3CH2OH | |
| D. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得0.05mol•L-1 H2SO4溶液的pH=1 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物一定为钾盐 | |
| C. | 滴定过程中,眼睛要始终注视锥形瓶中液体的颜色变化 | |
| D. | 配制FeSO4溶液时,先将FeSO4固体溶解在稀硫酸中,然后稀释到所需浓度,最后再加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④都要用到锥形瓶 | B. | ②③都要用到温度计 | ||
| C. | ③④都要用到酒精灯 | D. | ①②都要用到指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 标准状况下电解硫酸铜溶液时,阳极每生成气体3.36 L,转移电子数为0.6NA | |
| C. | 标准状况下,30gNO和16gO2混合所生成的气体分子数为NA | |
| D. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下水溶液的pH:Na2CO3>Na2SO4 | |
| B. | 酸性:H2SO3>H2CO3 | |
| C. | CH4比NH3更稳定 | |
| D. | C与H2的化合价比N2与H2的化合更容易 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com