
【题目】(1)AgNO3光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为___________________________________。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中Ag+的浓度为________mol·L-1,pH为________。
(3)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=________mol·L-1。

(4)25℃,0.10mol·L-1CH3COONH4溶液中粒子浓度由大到小的顺序为____________________(已知醋酸和一水合氨的电离常数相等)。
【答案】2AgNO3![]() 2Ag+2NO2↑+O2↑ 1.8×10-7 2 0.043 c(CH3COO—)=c(NH4+)>c(CH3COOH)=c(NH3·H2O)>c(H+)=c(OH—)
2Ag+2NO2↑+O2↑ 1.8×10-7 2 0.043 c(CH3COO—)=c(NH4+)>c(CH3COOH)=c(NH3·H2O)>c(H+)=c(OH—)
【解析】
试题本题考查化学方程式的书写,溶度积的计算,与pH有关图像分析,溶液中粒子浓度的大小关系。
(1)红棕色气体为NO2,反应中Ag元素的化合价由+1价降为0价,N元素的化合价由+5价降至NO2中的+4价,根据氧化还原反应规律,反应中还有O2生成,AgNO3光照分解的化学方程式为2AgNO3![]() 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。
(2)n(AgNO3)=0.018mol/L![]() 0.05L=0.0009mol,n(HCl)=0.02mol/L
0.05L=0.0009mol,n(HCl)=0.02mol/L![]() 0.05L=0.001mol,AgNO3与HCl充分反应后HCl过量,反应后溶液中c(Cl-)=c(HCl)剩余=
0.05L=0.001mol,AgNO3与HCl充分反应后HCl过量,反应后溶液中c(Cl-)=c(HCl)剩余=![]() =0.001mol/L,Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8
=0.001mol/L,Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8![]() 10-10,c(Ag+)=1.8
10-10,c(Ag+)=1.8![]() 10-10
10-10![]() 0.001=1.8
0.001=1.8![]() 10-7(mol/L)。H+没有参与反应,混合后c(H+)=
10-7(mol/L)。H+没有参与反应,混合后c(H+)=![]() =0.01mol/L,溶液的pH=-lgc(H+)=2。
=0.01mol/L,溶液的pH=-lgc(H+)=2。
(3)在溶液中存在物料守恒c(H2S)+c(HS-)+c(S2-)=0.10mol/L,由图像知pH=13时,c(S2-)=5.7![]() 10-2mol/L,则c(H2S)+c(HS-)=0.10mol/L-5.7
10-2mol/L,则c(H2S)+c(HS-)=0.10mol/L-5.7![]() 10-2mol/L=0.043mol/L。
10-2mol/L=0.043mol/L。
(4)CH3COONH4在溶液中的水解离子方程式为CH3COO-+NH4++H2O![]() CH3COOH+NH3·H2O,醋酸和一水合氨的电离常数相等,CH3COO-、NH4+的水解程度相同,溶液呈中性,水解生成的c(CH3COOH)=c(NH3·H2O),溶液中粒子浓度由大到小的顺序为c(CH3COO-)=c(NH4+)
CH3COOH+NH3·H2O,醋酸和一水合氨的电离常数相等,CH3COO-、NH4+的水解程度相同,溶液呈中性,水解生成的c(CH3COOH)=c(NH3·H2O),溶液中粒子浓度由大到小的顺序为c(CH3COO-)=c(NH4+)![]() c(CH3COOH)=c(NH3·H2O)
c(CH3COOH)=c(NH3·H2O)![]() c(H+)=c(OH-)。
c(H+)=c(OH-)。


科目:高中化学 来源: 题型:
【题目】若把周期表原先的主、副族号取消,由左到右按原顺序编为18纵行。如碱金属为第1纵行,稀有气体为第18纵行,按这个规定,下列说法不正确的是( )
A.计算机芯片的组成元素位于第14纵行
B.第10纵行元素全部是金属元素
C.第18纵行元素单质全部是气体
D.只有第2纵行元素的原子最外层有2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中一种为金属元素。m、n、p、q、r、s是由这些元素组成的二元或三元化合物,t是元素Y的常见单质,m 是一种具有特殊颜色的气体,p 可作漂白剂、供氧剂。上述物质的转化关系如图所示。下列说法中不正确的( )
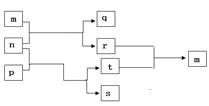
A. 四种元素简单离子半径:X〉Y〉Z〉W
B. p、s中的化学键类型完全相同
C. X、Y的简单氢化物的沸点:Y〉X
D. 常温下,0.01mol/L q溶液的pH为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取.收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入盛饱和澄清石灰水的烧杯里,不可能观察到的现象是
A.钠熔成小球并在液面上游动
B.溶液底部有银白色物质生成
C.有气体生成
D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“![]() =
=![]() ”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。
”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。

下列叙述中正确的是( )
A. 甲组操作时,电流表(A)指针发生偏转
B. 甲组操作时,溶液颜色变浅
C. 乙组操作时,C2作正极
D. 乙组操作时,C1上发生的电极反应为I2+2e-===2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
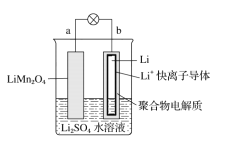
A. a为电池的正极
B. 电池充电反应为![]()
C. 放电时,a极锂的化合价发生变化
D. 放电时,溶液中Li+从b向a迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com