
【题目】在给定条件下,下列物质间的转化均能实现的有( )
①NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
②Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
③AgNO3(aq)![]() [Ag(NH2)2]+(aq)
[Ag(NH2)2]+(aq)![]() Ag(s)
Ag(s)
④Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
⑤NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
⑥MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
⑦N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
A.2个B.3个C.4个D.5个
【答案】A
【解析】
①NaHCO3受热分解成Na2CO3、CO2和H2O,Na2CO3与饱和石灰水反应生成CaCO3和NaOH,两步反应均能实现,故①正确。
②Al与NaOH溶液反应生成NaAlO2和H2,NaAlO2与过量盐酸反应生成NaCl、AlCl3和H2O,第二步反应不能实现,故②错误。
③AgNO3中加入氨水可获得银氨溶液,蔗糖中不含醛基,蔗糖不能发生银镜反应,第二步反应不能实现,故③错误。
④Al与Fe2O3高温发生铝热反应生成Al2O3和Fe,Fe与HCl反应生成FeCl2和H2,第二步反应不能实现,故④错误。
⑤氯气具有强氧化性,则铁与氯气反应生成三氯化铁,而不是氯化亚铁,第二步不能实现,故⑤错误。
⑥氯化镁与石灰乳转化为更难溶的氢氧化镁,Mg(OH)2不稳定,加热分解为 MgO ,故两步都可以实现,故⑥正确。
⑦氨气通入饱和食盐水中,在通入二氧化碳气体可以制碱,但反应生成的是碳酸氢钠,第二步不能转化,故⑦错误。
故①⑥正确,故答案选A。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
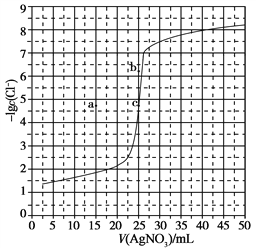
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.7.8 g的Na2S和Na2O2的混合物中含有阴、阳离子总数为0.3 NA
B.常温常压下,22.4 LCO2中含有NA个CO2分子
C.1.0 L 1.0 mol·L-1的NaClO水溶液中含有的氧原子数为NA
D.常温常压下,18 g羟基(-O2H)中所含的中子数为8 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g) +H2O(g)== CO2(g)+H2(g)。
已知在25℃时:
①C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH1=111kJ·mol 1
CO(g) ΔH1=111kJ·mol 1
②H2(g)+![]() O2(g)== H2O(g) ΔH2=242kJ·mol 1
O2(g)== H2O(g) ΔH2=242kJ·mol 1
③C(s)+O2(g) == CO2(g) ΔH3=394kJ·mol 1
下列说法不正确的是
A. 25℃时,CO(g)+H2O(g)==CO2(g)+H2(g) ΔH=41kJ·mol1
B. 增大压强,反应①的平衡向逆反应方向移动,平衡常数K减小
C. 反应①达到平衡时,每生成1molCO的同时生成0.5molO2
D. 反应②断开2molH2和1molO2中的化学键所吸收的能量比形成4molO-H键所放出的能量少484kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷直接氧化制甲醇是富有挑战性的课题,Sen等在CF3COOH水溶液中成功将甲烷转化为CF3COOCH3(水解生成CH3OH),其反应机理如图所示,下列说法正确的是( )
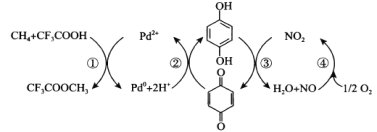
A.上述反应的总反应式为CH4+CF3COOH+![]() O2→CF3COOCH3
O2→CF3COOCH3
B.CF3COOCH3水解生成CH3OH的反应式为CF3COOCH3+H2O→CF3COOH+CH3OH
C.Pd2+是该反应的中间产物
D.每生成1molCH3OH,消耗标准状况下O2的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组利用实验室中的一瓶未知白色固体粉末进行了如下实验:
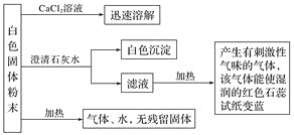
请回答下列问题:
(1)白色沉淀为______________________(填化学式,下同),产生的有刺激性气味的气体是_____________________。
(2)该白色固体粉末是___________________(填化学式)。
(3)写出该白色固体粉末受热分解的化学方程式:_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫脱硝是环境治理的热点问题。
(1)氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)ΔH=-1627.2kJ/mol。检验脱硝效果的重要指标是脱硝效率(脱硝过程中单位时间内NOx浓度变化占烟气初始浓度的百分比)。影响SCR系统脱硝效率的因素有很多,根据如图判断提高脱硝效率的最佳条件是__;氨氮比一定时,随温度的升高脱硝效率增大,其可能的原因是___。

(2)H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。原理:FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq)ΔH<0
FeY2-(NO)(aq)ΔH<0
①将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如图。时间越长,NO吸收率越低的原因是___。
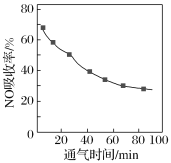
②生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理为FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。若吸收液再生消耗14 g铁粉,则所吸收的烟气中含有NO的物质的量为__mol。
(3)以连二硫酸盐(S2O42-)为媒介,使用间接电化学法也可处理NO,装置如图所示:阴极的电极反应式为___。
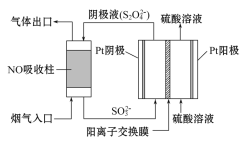
(4)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO42-。
①KMnO4脱硫(SO2)的离子方程式为____。
②加入CaCO3的作用是___。
(5)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,溶液pH对脱硫脱硝的影响如图所示:图中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释二者去除率不同的可能原因是__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH﹣+H++![]() →BaSO4↓+H2O
→BaSO4↓+H2O
B. 将Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓
C. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO﹣+CO2↑+H2O
D. 将Cl2通入水中:Cl2+H2O===2H++Cl﹣+ClO﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com