
SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ.则S(s)+ 3F2(g)= SF6 的反应热△H为______________________________。
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?______,理由是______
_____________________________________________________________________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___________(填序号);
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是_________________
___________________________________________________________。
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有_________(填序号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有__________(填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中D是正确的,混合后溶液中的溶质为 。
(3)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则混合前a b(填“>”、“<”、或“=”), 用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液一定呈中性的是
A.将pH=5的盐酸稀释100倍所得溶液
B. c(H+)=1.0×10-7mol/L
C.c(H+)=c(OH-)=1×10-6mol/L的溶液
D.非电解质溶于水得到的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NH3·H2O(aq)与H2SO4(aq)反应生成1mol正盐的反应热
△H= -24.2kJ/moL;稀盐酸与稀氢氧化钠溶液反应的中和热△H= -57.3kJ/mol。
则NH3•H2O在水溶液中电离的△H等于
A.-69.4kJ/mol B.-45.2 kJ/mol C.+69.4kJ/mol D.+45.2 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A: 4HCl+O2  2Cl2+2H2O
2Cl2+2H2O
(1)已知:i 反应A中, 4 mol HCI被氧化,放出115.6kJ的热量。[
mol HCI被氧化,放出115.6kJ的热量。[
ii 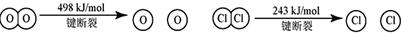 m
m
①H2O的电子式是_______________.
②反应A的 热化学方程式是____________________________________________________。
热化学方程式是____________________________________________________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
键所需能量相差约为__________kJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
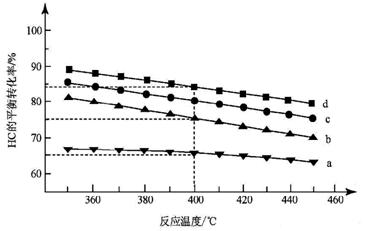 (2)对于反应A,下图是4种投料比[n(HCl):n(O2),
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),
分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是__________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度高低与投料比多少的关系是 ______________________________。
______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2 的物质的量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA为阿伏加德罗常数的值)( )
A.28 g氮气含有的原子数为NA
B.4 g金属钙变成钙离子时失去的电子数为0.1NA
C.1 mol O2分子的质量等于1 mol氧原子的质量
D.24 g O2分子和24 g O3分子所含的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对氧化还原反应的分析中不合理的是( )
A.Mg变为MgO时化合价升高,故Mg在该反应中作还原剂
B.在反应2H2S+SO2====3S+2H2O中,氧化产物和还原产物都是S
C.凡是氧化还原反应都有利于生产、生活
D.在反应2H2O 2H2↑+O2↑中,H2O既是还原剂又是氧化剂
2H2↑+O2↑中,H2O既是还原剂又是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com