
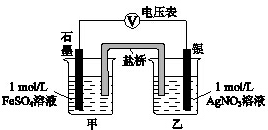
 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
分析 (1)将2mL 1mol/L AgNO3溶液加入到1mL 1mol/L FeSO4溶液中分数复分解反应会生成硫酸银白色沉淀,银离子具有强氧化性会氧化Fe2+为Fe3+,银离子被还原为黑色固体金属单质银;取上层清液,滴加KSCN溶液溶液变红说明有铁离子生成;
(2)①偏移的方向表明:电子由石墨经导线流向银,银做原电池正极,石墨做原电池负极,甲池溶液中是亚铁离子失电子发生氧化反应生成铁离子,;
②随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,证明银做原电池负极,发生的反应为铁离子氧化为银;
③实验可知银离子具有强氧化性氧化亚铁离子为铁离子;
(3)①酸性溶液中硝酸根离子具有氧化性,也可以溶解银;
②分析选项可知,溶液中存在平衡:Fe3++Ag=Fe2++Ag+,硫酸根离子和氯离子对平衡的影响判断平衡进行的方向解释.
解答 解:(1)将2mL 1mol/L AgNO3溶液加入到1mL 1mol/L FeSO4溶液中分数复分解反应会生成硫酸银白色沉淀,银离子具有强氧化性会氧化Fe2+为Fe3+,银离子被还原为黑色固体金属单质银;取上层清液,滴加KSCN溶液溶液变红说明有铁离子生成;
①上述分析可知白色沉淀为硫酸银,它的化学式是Ag2SO4,故答案为:Ag2SO4;
②甲同学得出Ag+氧化了Fe2+的依据是实验现象中,银离子被还原为黑色固体金属单质银,取上层清液,滴加KSCN溶液溶液变红说明有铁离子生成,
故答案为:有黑色固体(Ag)生成,加入KSCN溶液后变红;
(2)①实验过程中电压表指针偏移,偏移的方向表明:电子由石墨经导线流向银,依据原电池原理可知银做原电池正极,石墨做原电池负极,负极是甲池溶液中亚铁离子失电子发生氧化反应生成铁离子,a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+;
故答案为:Fe2+-e-=Fe3+;
②随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,依据电子流向可知乙池中银做原电池负极,发生的反应为铁离子氧化为银生成亚铁离子;
故答案为:负;
③由实验现象得出,Ag+和Fe2+反应生成铁离子和金属银,反应的离子方程式是Fe2++Ag+?Fe3++Ag;
故答案为:Fe2++Ag+?Fe3++Ag;
(3)①将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中银镜消失,说明银杯氧化,可能是溶液中铁离子的氧化性,也可能是铁离子水解显酸性的溶液中,硝酸根离子在酸溶液中具有了强氧化性,稀硝酸溶解银,所以实验Ⅲ不能证明Fe3+氧化了Ag,
故答案为:不能;因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag;
②将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中银镜减少,未消失说明部分溶解,将2mL 2mol/L FeCl3溶液加入有银镜的试管中银镜消失,说明银溶解完全,依据上述现象可知,溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大,
故答案为:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
点评 本题考查了物质性质的实验设计验证,物质性质的理解,原电池原理分析,主要是实验现象和反应产物分析判断,注意题干信息的理解应用,掌握基础是关键,题目难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
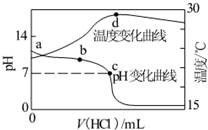 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | 氨水的电离程度a>b>c | |
| B. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) | |
| C. | c点时消耗盐酸体积V(HCl)<20.00mL | |
| D. | d点时溶液温度达到最高,之后温度略有下降,原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钛属于主族元素 | |
| B. | 钛合金强度很大 | |
| C. | 蒸干TiCl4溶液可得无水钛盐 | |
| D. | 在空气中将金属钛、铝混合后熔化可制得合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清溶液中加入醋酸铅溶液,会发生盐析 | |
| B. | 青苹果中富含苹果酸,因此苹果是酸性食物 | |
| C. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 | |
| D. | 氢氧化钠、碳酸钙、氢氧化铝等可作为抗酸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NH4+、HCO3-、AlO2- | B. | K+、Cl-、Fe3+、SO42- | ||
| C. | K+、I-、ClO-、Na+ | D. | Na+、SO32-、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧一定要用火去点燃 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界.这一完美结合现实与理论的化学系统模型,为更全面了解并预测化学反应进程奠定了基础 | |
| D. | 化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com