
| A、0.2 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.45 mol?L-1 |
| D、0.225 mol?L-1 |
| 1 |
| 4 |
| 1 |
| 4 |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
| A、硫酸和磷酸的摩尔质量相等 |
| B、2g氢气中含有1mol氢 |
| C、O2的摩尔质量(单位是g?mol-1)在数值上等于其相对分子质量 |
| D、1molCO的质量是28g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| B、使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大 |
| C、分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出 |
| D、用托盘天平称量11.74 g氯化钠晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知(CH3COOH)2(g)?2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( )
已知(CH3COOH)2(g)?2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( )| A、该过程的△H<0 |
| B、气体压强:p(a)<p(b)=p(c) |
| C、平衡常数:K(a)=K(b)<K(c) |
| D、测定乙酸的相对分子质量要在高压、低温条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol硫酸钾中阴离子所带电荷数为NA |
| B、常温下,2.7克铝与足量的稀硫酸反应,失去的电子数为0.1NA |
| C、在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+ 数等于NA |
| D、在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
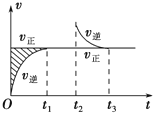 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件.下列有关说法中正确的是( )| A、Z和W在该条件下都不可能为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
| D、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应式为Pb-2e-+SO42-=PbSO4 |
| B、充放电时,溶液的导电能力变化不大 |
| C、以该电池电解NaCl溶液时,当消耗207gPb时,在阳极生成Cl222.4L |
| D、充电时的阳极反应式为Pb 2++2e-+4OH-=PbO2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com