

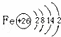 .
.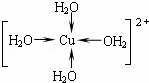 .
.分析 (1)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,根据原子结构示意图的书写规则书写;
(2)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,写出相应的元素符号;
(3)原子的外围电子排布是4s24p4,处于第四周期IVA族;
(4)计算中心原子价层电子对数、孤电子对数,判断分子空间构型;
(5)利用均摊法计算晶胞中含有的原子个数;体心立方密堆积中体对角线长度为Fe原子直径的2倍,为晶胞棱长的$\sqrt{3}$倍,面心立方密堆积中面对角线长度为Fe原子直径的2倍,为晶胞棱长的$\sqrt{2}$倍,结合晶胞的密度等于晶胞中铁原子的质量与体积的比计算;
(6)①铜是29号元素,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;
②CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4;
(7)决定离子空间结构的因素有有三个方面:几何因素、电荷因素、离子键的纯粹程度.
解答 解:(1)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,其原子结构示意图为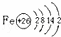 ,故答案为:
,故答案为: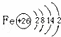 ;
;
(2)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,所以当另一个3p轨道上没有电子,该原子是Si;一种是另一个3p轨道上充满电子,该原子是S,故答案为:Si或S;
(3)原子的外围电子排布是4s24p4,说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,故答案为:硒;
(4)根据VSEPR模型得,H3O+的价层电子对=3+$\frac{1}{2}$(6-1-3×1)=4,有1个孤电子对,所以是三角锥形;SO2的价层电子对=2+$\frac{1}{2}$(6-2×2)=3,有1个孤电子对,所以是V形,
故答案为:三角锥形;V形;
(5)体心立方晶胞中铁原子个数=1+8×$\frac{1}{8}$=2;面心立方晶胞中实际含有的Fe原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;
设体心立方中晶胞的棱长为x,铁原子的直径为A,则3x2=(2A)2,解得x=$\frac{2\sqrt{3}A}{3}$;
铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长=$\sqrt{2}$A,其晶胞体积=2$\sqrt{2}$A3.体心立方的密度与面心立方的密度之比=$\frac{2m}{(\frac{2\sqrt{3}A}{3})^{3}}$:$\frac{4m}{2\sqrt{2}{A}^{3}}$=3$\sqrt{6}$:8,
故答案为:1:2; 3$\sqrt{6}$:8;
(6)①铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
②CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.水合铜离子的结构简式为 ,故答案为:
,故答案为: ;
;
(7)决定离子空间结构的因素有有三个方面:几何因素、电荷因素、离子键的纯粹程度,
故答案为:几何因素;电荷因素.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物的成键情况、空间构型判断、晶胞的计算等,掌握均摊法进行晶胞有关计算,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-?CH3COO-+H2O | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | S2-+H2O?HS-+OH- | D. | NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气前要检验纯度,以免发生爆炸 | |
| B. | 不慎将浓盐酸沾到皮肤上,要立即用浓碱溶液冲洗 | |
| C. | CO气体有毒,处理CO尾气的方法一般是将其点燃,转化成无毒的CO2 | |
| D. | 在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象与结论(或装置用途) |
| A | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
| B |  | 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
| C | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸中 | 试纸变蓝,说明NH3溶于水显碱性 |
| D |  | 用图所示装置分离沸点相差较大的互溶液体混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
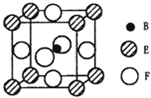 A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
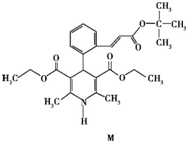
| A. | 属于芳香烃 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 1 mol M完全水解生成2 mol醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com