
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
(2)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
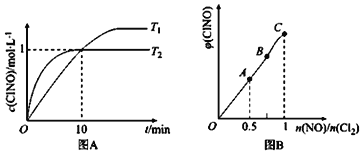
① 由图A可判断T1 ____T2,该反应的△H____0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=______mol/(L·min)。
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
【答案】289-2a<<0.1A
【解析】
(1)2NO(g)+C12(g)![]() 2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和;(2)由图象可知T2先达到平衡状态,且生成物的浓度小,则升高温度平衡逆向移动;(3)n(NO)/n(C12)的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大。
2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和;(2)由图象可知T2先达到平衡状态,且生成物的浓度小,则升高温度平衡逆向移动;(3)n(NO)/n(C12)的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大。
(1)反应的△H=反应物的总键能-生成物的总键能,则△H=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
(2)①根据图象先拐先平可知T1<T2,温度越高,反应速率越大,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0;
②在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),10min时c(ClNO)=1mol/L,则此时c(NO)=1mol/L,v(NO)=![]() =0.1mol/(Lmin);
=0.1mol/(Lmin);
(3)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,为A点。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-31 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_____________________________________________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5 mol·L-1时,认为该离子沉淀完全)。
(3)滤渣B的成分是______________。
(4)碱性锌锰电池中,MnO2参与的电极反应式为__________________________________。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为___________________________________。
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算可得该样品纯度为_____________。(保留一位小数)
)。计算可得该样品纯度为_____________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:

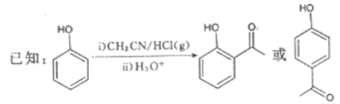
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
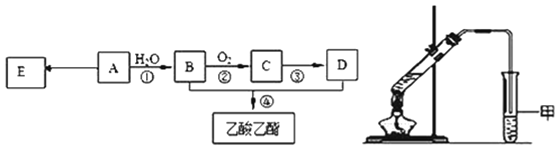
(1)0.1mol该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
(2)B中官能团的名称是_________,B通过两次氧化可得到D,也可通过加入的氧化试剂为______任填一种直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式__________;合成E的反应类型_________;
(4)某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________________;
②上述实验中饱和碳酸钠溶液的作用是______________________。
③乙醇与乙酸反应的化学方程式是:__________________, 浓硫酸的作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
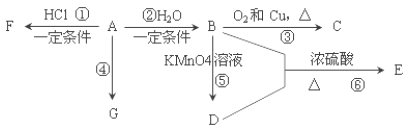
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A. 氯水中有下列平衡Cl2+H2O ![]() HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
D. 对2HI(g)![]() H2(g)+I2(g),保持容器体积不变,通入氢气可使体系颜色变浅
H2(g)+I2(g),保持容器体积不变,通入氢气可使体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2+3B2 ===2AB3反应来说,以下反应速率表示反应最快的是
A. v(AB3)=0.5 mol·L-1·min-1 B. v(A2)=0.4mol·L-1·min-1
C. v(B2)=0.6 mol·L-1·min-1 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g),ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示,下列说法正确的是
nY(g),ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示,下列说法正确的是
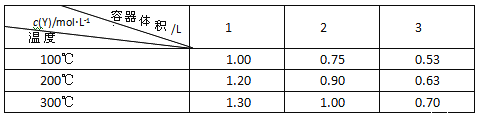
A. m>n B. 温度不变,压强增大,Y的质量分数减少
C. Q<0 D. 体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com