
| A. | 100g 30% CH3COOH溶液中含氢原子数为2NA | |
| B. | 标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA | |
| C. | 16gO3和O2混合物中含氢原子数为NA | |
| D. | 精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
分析 A、醋酸溶液中除了醋酸,水也含氢原子;
B、标况下四氯化碳为液态;
C、氧气和臭氧均由氧原子构成;
D、精炼铜时,阳极上为粗铜.
解答 解:A、醋酸溶液中除了醋酸,水也含氢原子,故溶液中的氢原子的个数大于2NA个,故A错误;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和C-Cl键的个数,故B错误;
C、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,故含NA个,故C正确;
D、精炼铜时,阳极上为粗铜,而粗铜中除了铜,还含有比铜活泼的金属,故当阳极质量减少6.4g时,电路中转移的电子数多于0.2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1 L0.05mol?L-1 CH3 COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准状况下,44.8 LCCl4含有的分子数为2NA | |
| D. | 反应:ClO3-+5Cl-+6H+=3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20种 | B. | 29种 | C. | 30种 | D. | 48种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
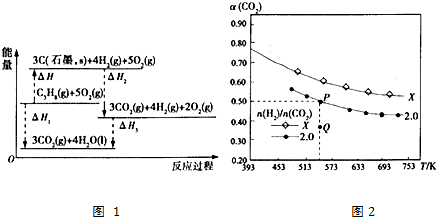
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
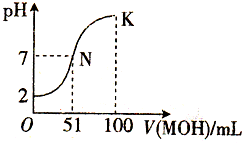 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )| A. | MA溶液的pH>7 | B. | K点时加水稀释溶液,c(H+)减小 | ||
| C. | 在N点,c(A-)=c(M+)+c(MOH) | D. | 在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

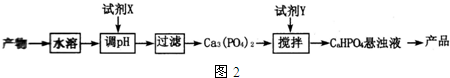
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
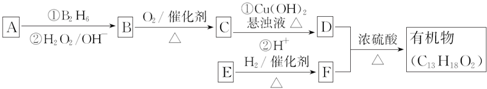
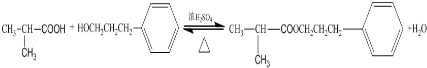 .E发生银镜反应的离子方程式为
.E发生银镜反应的离子方程式为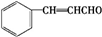 +2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$
+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ +2Ag↓+3NH3+NN4++H2O.
+2Ag↓+3NH3+NN4++H2O.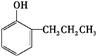 等.
等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com