
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C、某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| D、标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
| m |
| M |
| 7.0g |
| 14g/mol |


科目:高中化学 来源: 题型:
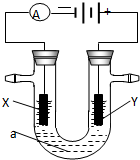 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属 | Na | Cu | Al | Fe |
| 熔点(℃) | 97.5 | 1 083 | 660 | 1 535 |
| 沸点(℃) | 883 | 2 595 | 2 200 | 3 000 |
| A、Cu与Al |
| B、Fe与Cu |
| C、Fe与Na |
| D、Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ |
| B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C、常温下,c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32- |
| D、常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、SO42-、Br-、SiO32- |
| B、H+、Fe2+、Cl-、NH4+ |
| C、Na+、Ba2+、NO3-、Cl- |
| D、Na+、Ag+、NH3?H2O、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两个原子之间形成共价键时,最多有一个σ键 |
| B、σ键比π键重叠程度大,形成的共价键强 |
| C、N2分子中有一个σ键,2个π键 |
| D、气体单质中,一定有σ键,可能有π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入HCl气体 |
| B、不用铁片,改用铁粉 |
| C、滴加少量硫酸铜溶液 |
| D、加入KNO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | I | |||||||||||||
| E | F | G | H | M | |||||||||||||
| J | K | ||||||||||||||||
| L | |||||||||||||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属单质燃烧时火焰均为无色 |
| B、NaCl与Na2CO3灼烧时火焰颜色相同 |
| C、焰色反应均应透过蓝色钴玻璃观察 |
| D、只有金属单质灼烧时火焰才有颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com