
| A. | 1gH2 | B. | 11gCO2 | C. | 8gO2 | D. | 4.5gH2O(g) |
分析 根据N=nNA可知,气体的物质的量越大,则含有气体分子数越多,根据n=$\frac{m}{M}$分别计算出各物质的物质的量,然后比较物质的量大小即可.
解答 解:根据N=nNA可知,气体的物质的量越大,则含有气体分子数越多,
A.1g H2的物质的量为:$\frac{1g}{2g/mol}$=0.5mol;
B.11g CO2的物质的量为:$\frac{11g}{44g/mol}$=0.25mol;
C.8g O2的物质的量为:$\frac{8g}{32g/mol}$=0.25mol;
D.4.5gH2O(g)的物质的量为:$\frac{4.5g}{18g/mol}$=0.25mol;
根据分析可知,物质的量最大的为A,则含有分子数最多的为A,
故选A.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 跟水反应时,水作氧化剂 | B. | NaH在水中显酸性 | ||
| C. | 跟液氨反应时,有NaNH2生成 | D. | 跟乙醇反应时,NaH被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
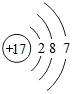 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
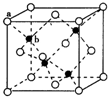 E、G、M、Q、T是五种原子序数依次增大的前四周期元素E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与QM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与QM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: (若有配位键,请用“→”表示),E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性;
(若有配位键,请用“→”表示),E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性; 查看答案和解析>>
科目:高中化学 来源: 题型:多选题
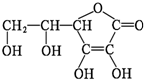 维生素C是一种重要的维生素,能防治坏血病,又称为抗坏血酸,其结构简式如图,下列有关它的叙述错误的是( )
维生素C是一种重要的维生素,能防治坏血病,又称为抗坏血酸,其结构简式如图,下列有关它的叙述错误的是( )| A. | 它的分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 它是一种脂溶性维生素 | D. | 在碱性溶液中不能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含3.01×1023个氮原子的N2 | B. | 标准状况下11.2 L H2 | ||
| C. | 1 mol Na2SO4中的Na+ | D. | 常温常压下32 g O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 矿泉水中不含任何化学物质 | |
| B. | 聚乙烯塑料薄膜可用作食品包装袋 | |
| C. | 碳酸钡可用作医疗上的“钡餐” | |
| D. | 氢氧化钠可用作治疗胃酸过多的药物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com