
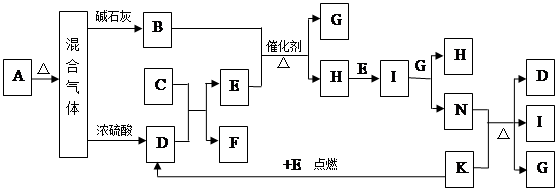
 CaCl2 + 2H2O +2 NH3↑(2分)
CaCl2 + 2H2O +2 NH3↑(2分)  4NO+6H2O,所以生成1molNO转移电子的物质的量是2-(-3)=5mol。
4NO+6H2O,所以生成1molNO转移电子的物质的量是2-(-3)=5mol。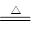 CaCl2 + 2H2O +2 NH3↑。
CaCl2 + 2H2O +2 NH3↑。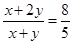 ,解得x:y=2:3,则用物质的量的关系表示此固体A的组成为NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。
,解得x:y=2:3,则用物质的量的关系表示此固体A的组成为NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:不详 题型:推断题
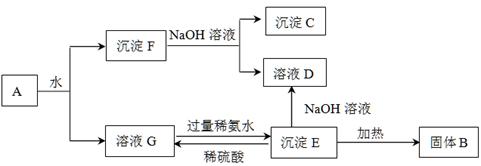
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4 则ⅤA族元素氢化物沸点顺序也是AsH3 >PH3 >NH3 |
| B.第二周期元素氢化物稳定性顺序是HF>H2O>NH3 则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
| C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
| D.干冰(CO2)是分子晶体;则二氧化硅(SiO2)是分子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:X > Y > Z | B.气态氢化物的稳定性:HX > H2Y > ZH3 |
| C.非金属性:X > Y > Z | D.阴离子的半径:Z3- > Y2- > X- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
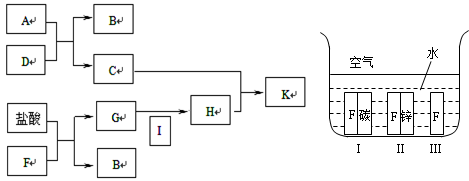
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | | | | | | | | |
| 2 | | | | G | H | | D | |
| 3 | B | | C | | | | E | |
| 4 | F | A | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com