
【题目】一定温度下,反应![]() ,在密闭容器中达到平衡状态,下列说法正确的是( )
,在密闭容器中达到平衡状态,下列说法正确的是( )
A.体积不变,加少许![]() 化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
B.加压时(体积变小),将使正反应速率增大,逆反应速率减慢
C.体积不变,加少许![]() ,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
D.保持体积不变,升高温度,化学平衡正向移动,再达到平衡状态时混合气体密度变小
科目:高中化学 来源: 题型:
【题目】图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。

回答下列问题:
(1)图B对应的物质名称是_________,其晶胞中的原子数为______,晶体类型为_______。
(2)d中元素的原子核外电子排布式为_______。
(3)图A中由二种元素组成的物质中,沸点最高的是______,原因是______,该物质的分子构型为_________,中心原子的杂化轨道类型为_________。
(4)图A中的双原子分子中,极性最大的分子是_________。
(5)k的分子式为_________,中心原子的杂化轨道类型为_________,属于_________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。已知H2CO3溶液中存在下列平衡:CO2+H2O![]() H2CO3 H2CO3
H2CO3 H2CO3![]() H+ + HCO3- HCO3-
H+ + HCO3- HCO3-![]() H+ + CO32-,下图为H2CO3、HCO3— 、CO32—在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。
H+ + CO32-,下图为H2CO3、HCO3— 、CO32—在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。
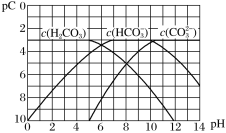
(1)在pH=11时,H2CO3溶液中浓度最大的含碳元素的离子为__________。
(2)由图可知,碳酸的一级电离常数Ka1大约为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡
时,下列说法正确的是( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的m/n倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:

已知信息如下:①RCH=CH2![]() RCH2CH2OH;
RCH2CH2OH;
②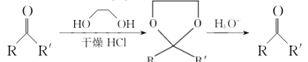 ;
;
③RCOOCH3  .
.
(1)A的结构简式为____,B →C的反应类型为___,C中官能团的名称为____,C→D的反应方程式为_____。
(2)写出符合下列条件的D的同分异构体_____(填结构简式,不考虑立体异构)。①含有五元环碳环结构;②能与NaHCO3溶液反应放出CO2气体;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子___,若有用“*”标出。
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备 的合成路线(其他试剂任选) ___。
的合成路线(其他试剂任选) ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJmol-1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ΔH= -226 kJmol-1
下列表述正确的是
A.1molCO燃烧时放出的热量为283kJmol-1
B.Na2O2(s)+CO(g)=Na2CO3(s)ΔH=-509kJmol-1
C.Na2O2(s)与CO2(g)反应放出226kJ热量时电子转移数为2NA
D.Na2O2和Na2CO3中阴阳离子个数比不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)为白色粉末,熔点400℃,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干燥空气中稳定,吸湿而分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如图:下列说法不正确的是( )
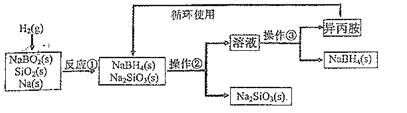
A.NaBH4中H元素显+1价
B.操作③所进行的分离操作是蒸馏
C.反应①为NaBO2+SiO2+4Na+2H2═NaBH4+2Na2SiO3
D.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,向20mL0.1molL-1HA溶液中逐滴加入0.1molL-1NaOH溶液,随滴入NaOH溶液体积的变化混合溶液的pH的变化如图所示。下列说法正确的是( )

A.A-的水解常数约为10-11
B.水的电离程度:e>d>c>b>a
C.c点和d点溶液中均符合c(Na+)=c(A-)
D.b点溶液中粒子浓度关系:c(A-)>c(HA)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是

A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com