
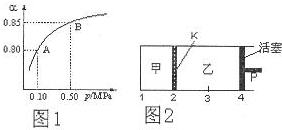
 ��3����ͼ2��ʾ�������¶Ȳ��䣬��һ����Ӧ�����£���2molSO2��1molO2����������У���4molSO2��2molO2�����������У�����K�����ƶ�����ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����
��3����ͼ2��ʾ�������¶Ȳ��䣬��һ����Ӧ�����£���2molSO2��1molO2����������У���4molSO2��2molO2�����������У�����K�����ƶ�����ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����
 ��1��ijͬѧͨ���ⶨO2��������Ƚ�H2O2�ķֽ����ʿ�����ʵ��ʱ����ͨ��������λʱ������O2����������ɵ�λ���O2����Ҫ��ʱ�����Ƚϣ�
��1��ijͬѧͨ���ⶨO2��������Ƚ�H2O2�ķֽ����ʿ�����ʵ��ʱ����ͨ��������λʱ������O2����������ɵ�λ���O2����Ҫ��ʱ�����Ƚϣ����� I����1���ٻ�ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ����ƽ��ʱ���������Ũ��ϵ������֮���뷴Ӧ���Ũ��ϵ������֮���ıȣ����塢��Һ�岻��Ҫ�ڻ�ѧƽ�ⳣ����д����
�ڿ��淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ�⣻
��2��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶���ͬ����ƽ�ⳣ����ȣ�
��3���ס�������ͬ���ʵ�Ũ����ͬ������Ϊ��Чƽ�⣬ƽ��ʱ��ͬ���ʵĺ�����ͬ��ƽ��ʱ��������������䣮
�����ƶ�����P������ѹǿ����ƽ�������ƶ���������ѹǿ��С��ƽ�������ƶ���
�����ڼ�������ͨ��һ������He�������������£�����ֵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���
��4���ڵ�5���ӽ������������Сһ���˲��SO3��Ũ�ȱ�Ϊ0.2mol/L��ѹǿ����ƽ�������ƶ���SO3��Ũ�������ڵ�8���Ӵﵽ�µ�ƽ��ʱSO3��Ũ��ԼΪ0.25mol/L��
��1��ʵ��ʱ����ͨ��������λʱ������O2����������ɵ�λ���O2����Ҫ��ʱ�����Ƚϣ�
��2�����ŷ�Ӧ�Ľ��У���Һ��Ũ�����ͣ���Ӧ������С������ͼ����Կ���H2O2��ȫ��Ӧ�ų�60 mL O2������2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2�����м��㣮
��� �⣺��1����2SO2��g��+O2��g��?2SO3��g����ƽ�ⳣ������ʽK=$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}����c��{O}_{2}��}$���ʴ�Ϊ��$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}����c��{O}_{2}��}$��
��a��SO2��SO3Ũ������ʼ����ת�����йأ�SO2��SO3Ũ����ȣ�����˵����Ӧ�ﵽƽ��״̬����a����
b��SO2�ٷֺ������ֲ��䣬˵����Ӧ�ﵽƽ��״̬����b��ȷ��
c����Ӧǰ��ѹǿ��ͬ�������������ѹǿ���䣬˵����Ӧ�ﵽƽ��״̬����c��ȷ��
d��SO3������������SO2������������ȣ���Ϊ����Ӧ���ʣ���Ӧʼ�հ��ñ�����ϵ���У�����˵����Ӧ�ﵽƽ��״̬����d����
�ʴ�Ϊ��bc��
��2��ƽ�ⳣ��ֻ���¶�Ӱ�죬��ѹǿ�أ�ƽ��״̬��A�䵽Bʱ�������¶���ͬ����ƽ�ⳣ��K��A��=K��B�����ʴ�Ϊ��=��
��3���ס�������ͬ���ʵ�Ũ����ͬ������Ϊ��Чƽ�⣬ƽ��ʱ��ͬ���ʵĺ�����ͬ��ƽ��ʱ��������������䣮
�����ƶ�����P������ѹǿ����ƽ�������ƶ�������SO3���������������ѹǿ��С��ƽ�������ƶ�������SO3�����������С����SO3�����������С���ң��ʴ�Ϊ��С�ڣ�
�ڼ�Ϊ���º�������������һ�����ĺ���������ֵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�����$\frac{c��S{O}_{3}��}{c��S{O}_{2}��}$���䣬�ʴ�Ϊ�����䣻
��4���ڵ�5���ӽ������������Сһ���˲��SO3��Ũ�ȱ�Ϊ0.2mol/L��ѹǿ����ƽ�������ƶ���SO3��Ũ�������ڵ�8���Ӵﵽ�µ�ƽ��ʱSO3��Ũ��ԼΪ0.25mol/L���˱仯������SO3Ũ�ȵı仯����Ϊ��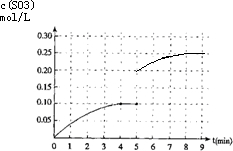 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��1��ͨ���ⶨO2��������Ƚ�H2O2�ķֽ����ʿ�����ʵ��ʱ����ͨ��������λʱ������O2����������ɵ�λ���O2����Ҫ��ʱ�����Ƚϣ�
�ʴ�Ϊ����λʱ������O2����������ɵ�λ���O2����Ҫ��ʱ�䣻
��2��Ũ��Խ��Ӧ����Խ��֮ԽС�����ŷ�Ӧ���У���Ӧ���Ũ����С����������С��
����ͼ����Կ���H2O2��ȫ��Ӧ�ų�60 mL O2��H2O2�ķֽⷴӦΪ2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2������n��H2O2��=$\frac{0.06L}{22.4L/mol}$��2��0.00536 mol������H2O2�ij�ʼ���ʵ���Ũ��Ϊ��c��H2O2��=$\frac{0.00536mol}{0.05L}$��0.11 mol/L��
�ʴ�Ϊ�����ŷ�Ӧ�Ľ��У�Ũ�ȼ�С����Ӧ���ʼ�����0.11 mol/L��
���� ���⿼�黯ѧƽ�ⳣ����ƽ��״̬�жϡ�Ӱ�컯ѧƽ������������ƽ��ͼ��̽����Ӧ����Ӱ�����صȣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 16g/mol | B�� | 18g | C�� | 20g/mol | D�� | 18g/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ��HCl�����ʵ��� | B�� | ��Һ��Ũ�� | ||
| C�� | ��Һ��Cl-����Ŀ | D�� | ��Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com