
 如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )
如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )| A. | 开始时发生的是析氢腐蚀 | B. | -段时间后发生的是吸氧腐蚀 | ||
| C. | 两段时间内负极的电极反应相同 | D. | 两段时间内正极的电极反应相同 |
分析 酸雨的pH小于5.6,而酸性条件下,钢铁能发生析氢腐蚀,负极反应为:Fe-2e-═Fe2+,正极反应为:2H++2e-=H2↑,导致试管内气体压强增大;反应一段时间后,溶液的酸性减弱,钢铁腐蚀吸氧腐蚀,负极反应为:Fe-2e-═Fe2+,正极反应为:O2+2H2O+4e-=4OH-,导致试管内气体压强减小.据此分析.
解答 解:A、酸雨的pH小于5.6,电解质溶液显酸性,故开始钢铁发生析氢腐蚀,故A正确;
B、反应一段时间后,溶液的酸性减弱,钢铁腐蚀吸氧腐蚀,故B正确;
C、无论是析氢腐蚀还是吸氧腐蚀,铁都作负极,负极上发生的电极反应式都为Fe-2e-═Fe2+,故C正确;
D、开始时发生的是析氢腐蚀,正极反应为:2H++2e-=H2↑;后来发生的是吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-,故两段时间内的正极的电极反应不同,故D错误.
故选D.
点评 本题考查了原电池原理,明确钢铁发生析氢腐蚀和吸氧腐蚀所需溶液的酸碱性是解本题的关键,根据析氢腐蚀和吸氧腐蚀导致试管内气体压强的变化即可分析解答,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 它是一种白色粉末,溶解度小于Na2CO3 | |
| B. | 加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 | |
| C. | 与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 | |
| D. | 它是一种碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某反应的焓变小于零,该反应一定能自发进行 | |
| B. | 用湿润的PH试纸测稀盐酸溶液的pH为3.52 | |
| C. | 原电池是将化学能转变为电能的装置 | |
| D. | 草木灰(K2CO3)是钾肥,硫酸铵是氮肥,两者混合施用可以提高肥效 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
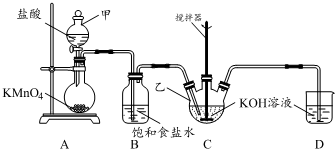 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-═CuS↓+H2S↑ | |
| B. | NH4Al(SO4)2溶液与足量的Ba(OH)2溶液混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 铅酸蓄电池充电时的阴极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
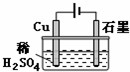
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主反应方程式为Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度几乎不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都能与水反应生成对应的酸 | |
| B. | 标准状况下它们都是无色无味的气体 | |
| C. | 分子中氧元素的质量分数:NO>NO2>SO2 | |
| D. | 实验室可以利用氧化还原反应分别制备NO、NO2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com