
| A. | 反应物浓度 | B. | 温度 | C. | 压强 | D. | 反应物本身性质 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | X2Z与X2M比较,稳定性:X2Z>X2M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.008mol/(L•s) | ||
| C. | v(H2O)=0.001mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的盐酸15mL | B. | 0.15 mol/L 的硫酸溶液8mL | ||
| C. | 0.2 mol/L 的盐酸12mL | D. | 18 mol/L的浓硫酸15mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
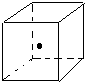 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
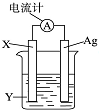 依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
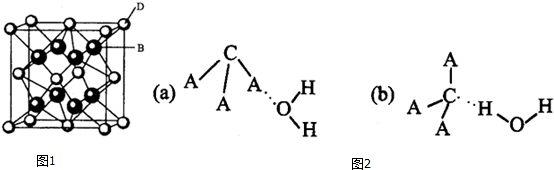
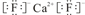 ;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).
;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用福尔马林保存生物标本 | |
| B. | 试管上沾有苯酚时,用水洗 | |
| C. | 实验室不慎将Hg洒在地上时,立即用硫粉覆盖 | |
| D. | 皮肤上沾有苯酚时,立即用酒精擦洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com