
| A. | SiO2是酸性氧化物,它对应的水化物是硅酸(H2SiO3) | |
| B. | 硅酸可由SiO2跟水反应制得 | |
| C. | SiO2可与碱性氧化物或强碱反应 | |
| D. | 光导纤维的主要原料就是SiO2 |
分析 A.能和碱反应生成盐和水的氧化物属于酸性氧化物,氧化物对应的酸中元素的化合价是一样的;
B.二氧化硅是不溶于水的氧化物;
C.SiO2能和碱反应生成盐和水,属于酸性氧化物;
D.SiO2是光导纤维的主要原料.
解答 解:A.二氧化硅能和碱氢氧化钠反应生成盐硅酸钠和水,该氧化物属于酸性氧化物,对应的酸是硅酸,故A正确;
B.二氧化硅是不溶于水的氧化物,硅酸不能由SiO2直接制得,故B错误;
C.SiO2酸性氧化物,能和强碱、碱性氧化物反应,故C正确;
D.SiO2是制造光导纤维的主要原料,故D正确.
故选B.
点评 本题考查学生二氧化硅的性质,注意二氧化硅是酸性氧化物,不溶于水,不能用二氧化硅制取硅酸,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2中所含阴离子的数目是0.2×6.02×1023 | |
| B. | 标准状况下,2.24L18O2中所含中子的数目是6.02×1023 | |
| C. | 1mol甲烷中含共用电子对的数目是4×6.02×1023 | |
| D. | 电解精炼铜时,当阳极溶解6.4g铜,则转移的电子数为6.02×1022个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| B. | 氧化钠是强电解质 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 溶液、胶体这两种分散系的本质区别是否有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中Fe3+物质的量为0.6mol | |
| B. | 反应后产生13.44L H2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.8mol | |
| D. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.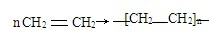 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
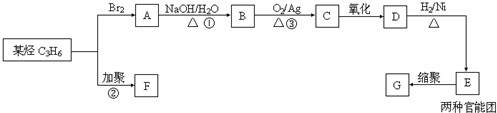
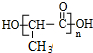 .
.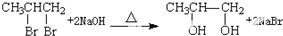 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .有机物X的键线式为:
.有机物X的键线式为: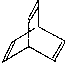


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com