
| A. | 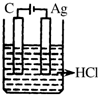 | B. | 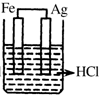 | C. | 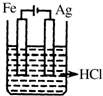 | D. | 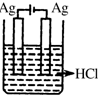 |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 22.4L的Cl2与足量Fe反应,转移的电子数为3NA | |
| C. | 50mL 18mol•L-1浓硫酸与足量Cu共热,转移的电子数为0.9MA | |
| D. | 高温下,0.3molFe与足量水蒸气反应,生成H2的分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | 镀锌铁镀层破损后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池负极的反应式为:Pb-2e -→Pb2+ | |
| B. | 铅蓄电池放电时,该电池两极质量均减少 | |
| C. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| D. | 电解苦卤水时,a电极首先放电的是Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
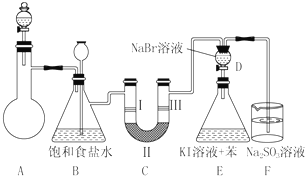
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
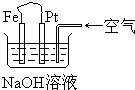
| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青石棉是一种易燃品且易溶于水 | |
| B. | 青石棉的化学组成用氧化物的形式可表示为:Na2O•FeO•2Fe2O3•8SiO2•H2O | |
| C. | 1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6 L 3 mol•L-1 HNO3溶液 | |
| D. | 1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5 L 2 mol•L-1HF溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH
.请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH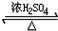 CH3COOCH2CH2CH3+H2O
CH3COOCH2CH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com