
分析 Ⅰ.(1)根据Na2S2O3和H2SO4反应生成了单质硫沉淀、硫酸钠和二氧化硫分析;
(2)探究Na2S2O3的浓度对反应速率的影响时,除了Na2S2O3的浓度不同外,其它条件必须完全相同;
(3)探究温度对反应速率的影响,两个烧杯中除温度不同外,其它条件必须完全相同,据此进行解;
Ⅱ.(1)配制一定量物质的量的浓度的溶液用到的定量仪器是容量瓶;
(2)根据弱电解质是部分电离来分析;
(3)根据弱电解质是部分电离,氢离子的浓度较小,反应速率更慢来分析;
(4)要得到有说服力的结论,必须统一其他条件,但是锌粒难以做到表面积相同;
(5)弱酸的强碱盐可以水解,水解显示碱性.
解答 解:(1)Na2S2O3和H2SO4反应生成气体二氧化硫,可通过观察气体产生的速度大致比较反应的快慢,
故答案为:气体产生的速度;
(2)通过改变Na2S2O3的浓度来验证浓度对反应速率的影响,除Na2S2O3的浓度不同外,所取硫酸溶液体积、溶液总体积必须完全相同,且两组溶液必须同时混合,
故答案为:所取稀硫酸的体积;溶液的总体积(或两组溶液必须同时混和);
(3)验证温度对反应速率的影响,需要设置对照试验,所以两个烧杯中除了温度不同以外,其它条件必须完全相同,如:①所取稀硫酸的体积、②所取Na2S2O3溶液的体积、③两组溶液必须同时混和,
故答案为:所取稀硫酸的体积;所取Na2S2O3溶液的体积(或③两组溶液必须同时混和);
Ⅱ.(1)配制100ml一定物质的量浓度溶液时需要的定量仪器是100ml容量瓶,故答案为:100mL溶量瓶;
(2)弱电解质存在电离平衡,不能完全电离,则0.1mol/L溶液的H+的浓度<0.1mol•L-1,故答案为:<;
(3)弱电解质是部分电离,氢离子的浓度较小,反应速率更慢,
A.装盐酸的试管中放出气体的速率快,盐酸是强酸,全部电离,两种一元酸浓度相同时,电离出的氢离子浓度是盐酸的大,则浓度大速率快,故A正确;
B.根据A的分析可知装HA溶液的试管中氢离子浓度较小,放出气体的速率慢,故B错误;
C.两个试管中产生气体的速率是盐酸中快,HA溶液中慢,故C错误;
故选A;
(4)要得到有说服力的结论,必须统一其他条件,但是锌粒难以做到表面积相同,故答案为:在于加入的锌粒难以做到表面积相同;
(5)弱酸的强碱盐能水解,弱酸根离子水解而使其溶液显碱性,所以可以配制NaA溶液,如果测定其溶液pH>7,则可证明HA是弱电解质,
故答案为:用蒸馏水配制少量NaA溶液,再测其pH,若pH>7,说明HA是弱电解质.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,明确设置对照试验的要求为解答关键,注意掌握温度、浓度、催化剂等体积对反应速率的影响,试题培养了学生的分析、理解能力及化学实验能力,本题还考查了弱电解质的判断,注意电解质的强弱是根据其电离程度划分的,不是根据溶液的导电能力划分的,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | B A D C E | B. | E C D A B | C. | A B E D C | D. | C D E B A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
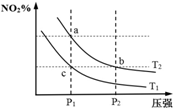 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 反应温度:T1>T2 | B. | b、c两点的反应速率:v(b)>v(c) | ||
| C. | a、c两点气体的颜色:a浅,c深 | D. | a、b两点的平衡常数:Kb>Ka |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b连接时,铜片上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有双键 | B. | 一定含有三键 | ||
| C. | 一定含有不饱和键 | D. | 可能含有苯环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙炔、乙烯、丙烯 | B. | 苯、甲苯、己烷 | ||
| C. | CH3CHO、CH3COOH、CH3CH2OH | D. | C6H5OH、C6H5C2H5、C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得0.1 mol/L 的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 向 NaAlO2溶液中通入过量CO2 制 Al(OH)3:CO2+AlO2-+2H20=HC03-+Al(OH)3↓ | |
| D. | 铅酸蓄电池在充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com