
| A. | 0.5molOH-中的电子 | B. | 1mol H2中的H原子 | ||
| C. | 0.6mol H2SO4中的O原子 | D. | 1molNa完全反应后失去的电子 |
科目:高中化学 来源: 题型:实验题
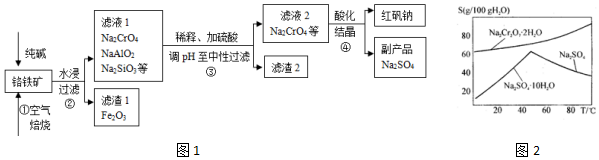
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 4:3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某硫酸试剂瓶标签上的内容:
如图是某硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸、强碱、大多数盐是强电解质,弱酸、弱碱和水是弱电解质 | |
| B. | 电解质溶液导电性的强弱跟单位体积溶液里自由移动的离子多少有关 | |
| C. | 具有强极性共价键的化合物一定是强电解质 | |
| D. | 硫酸钠是强电解质,碳酸氢钠也是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| B. | 未使用完的白磷要随时收集起来,并与空气隔绝 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z<Y<X<W | |
| B. | 气态简单氢化物的稳定性:Y<X | |
| C. | Q和M中的阴、阳离子个数比均为1:2,但化学键种类有差异 | |
| D. | Z与W能形成ZW或Z2W型离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com